
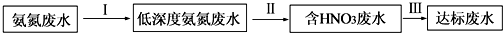
分析 (1)铵根能和强碱反应生成一水合氨,升高温度,气体溶解度减小;
(2)硝酸具有强氧化性,可加入还原剂.
解答 解:(1)铵盐能和强碱反应,实质是:NH4++OH-═NH3•H2O,升高温度,降低氨气的溶解度,通入空气,易于分离氨气,
故答案为:NH4++OH-═NH3•H2O;降低氨气的溶解度;
(2)硝酸具有强氧化性,可在硝酸废水中加入甲醇,发生氧化还原反应生成氮气和二氧化碳气体,故答案为:向废水中加入CH3OH,将HNO3还原成N2.
点评 本题综合考查物质的分离提纯,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关物质的性质以及氧化还原反应,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰电池是二次电池 | |
| B. | 铅蓄电池是二次电池 | |
| C. | 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 | |
| D. | 燃料电池的活性物质没有储存在电池内部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
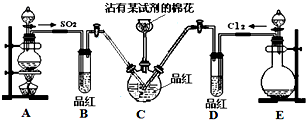 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
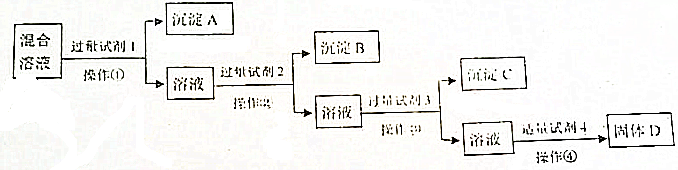
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g | B. | 11.2 g | C. | 22.4 g | D. | 20.16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com