
【题目】下列物质的使用不涉及化学变化的是
A.明矾用做净水 B.液氨用作制冷剂 C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是( )
A. Na、Mg、Al还原性依次减弱
B. I2、Br2、Cl2氧化性依次增强
C. C、N、O原子半径依次增大
D. P、S、Cl最高正价依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一,它可由下列方法合成。下列说法正确的是( )

A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入适量的NaHCO3有利提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe与过量的稀硫酸反应制取氢气,一定温度下为加快反应速率而又不影响氢气的量,可向其中加入
A.KCl固体 B.Zn粉 C.SO3固体 D.CuSO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液和Na2CO3溶液混合加热煮沸能产生CO2气体。下列说法中正确的是( )
A. NaHSO3溶液因水解而呈碱性
B. 两溶液混合后产生CO2的原因是二者发生相互促进的水解反应
C. 向NaHSO3溶液中加入三氯化铁溶液既有沉淀生成,又有气体生成
D. 0.1 mol·L-1的NaHSO3溶液中:c(HSO![]() )+2c(SO
)+2c(SO![]() )+c(OH-)-c(H+)=0.1 mol·L-1
)+c(OH-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO4-+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:_______________________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)______________。
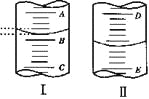
a.是amL b.是(50-a)mL
c.一定大于amL d.一定大于(50-a)mL
(3)如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图。

请指出A、B、C、D分别与①②③④相匹配的可能组合:
A与 ; B与 ;
C与 ; D与 。
(4) 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作。
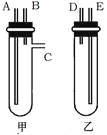
步骤如下:
①将锌粒放于 (填“甲”或“乙”,下同)装置中,将稀硫酸放于 装置中。
②用橡胶管连接对应接口(填编号):A接 ,B接 。
③将盛稀硫酸的试管倒置,即可发生反应放出气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知20℃时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的![]() 气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入
气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入![]() 气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
① 取440mL甲与120mL乙反应,产生1.56g沉淀;
② 取440mL乙与120mL甲反应,也产生1.56g沉淀;
③ 取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
甲溶液为 溶液,其物质的量浓度为 mol·L-1;
乙溶液为 溶液,其物质的量浓度是 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com