
关于分散系和胶体的说法正确的是 ( )
A.胶体、溶液、浊液都是分散系 B.粒子的半径:浊液>溶液>胶体
C.可见光通过溶液时,产生丁达尔现象 D.胶体都不透明,且稳定性极强
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
有机物CH2=CH﹣CH2﹣CH(OH)﹣COOH在不同条件下可能发生有机反应类型有:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚;⑦缩聚.其中因分子结构中含﹣OH而可能发生的反应有( )
|
| A. | ①④⑥⑦ | B. | ③④⑤ | C. | ②③④⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
组成中有氢氧根的盐叫做碱式盐,酸根中含有氢元素的盐叫做酸式盐.下列盐中,既不是碱式盐又不是酸式盐的是( )
|
| A. | KHSO4 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
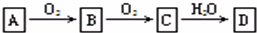
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①D的化学式是 ;
②在工业生产中,大量排放的B气体被雨水吸收后形成了 而污染环境.
(2)若A在常温下为气体,C是红棕色气体.
①A、C的化学式分别是:A ;C .
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式 .该反应 (填“属于”或“不属于”)氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
铁氧磁体法处理含Cr2O 的废水的原理如下:向含
的废水的原理如下:向含
Cr2O 的酸性废水中加入FeSO4·7H2O,将Cr2O
的酸性废水中加入FeSO4·7H2O,将Cr2O 还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成
还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成
相当于FeⅡ[Fe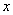 ·Cr
·Cr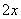 ]O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O
]O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O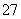 的废水至少需要
的废水至少需要
加入a mol FeSO4·7H2O。下列结论正确的是 ( )
A.x=0.5,a=8 B.x=0.5,a=10 C.x=1.5,a=8 D.x=1.5,a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种广谱型的消毒剂,根据世界环保联盟
的要求,ClO2将逐渐取代Cl2成为自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加入H2SO4
酸化后反应制得,在该反应中NaClO3和Na2SO3的物质的量之比为
A.3∶1 B.2∶3 C.1∶2 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.蒸馏石油时,应使温度计水银球放在蒸馏烧瓶的支管口处
C.分液操作时,上层液体经分液漏斗下口放出
D.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ). 某溶液可能含有Cl-、SO42-、CO32-、
NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红
褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的
沉淀。(已知Al(OH)3可被NaOH溶液溶解)由此可知原溶液中:
(1)至少存在  种离子
种离子
(2)Cl- 是 存在(填“一定”“一定不”“可能”),c(Cl‑)范围是 mol/L(若存在Cl- 则计算并填写,若不存在或可能存在Cl-,则此空不填)
(3)写出产生红褐色沉淀的离子方程式:
(Ⅱ).实验室要用98%(ρ=1.84 g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液500mL
(1)计算所需98%的硫酸 mL。
(2)要配制3.68mol·L-1的硫酸溶液500mL,准确量取一定体积的98%的硫酸后,还需用到的实验仪器是(填写序号): .
①量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是 。
A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用量筒量取浓硫酸时,俯视读数
D.容量瓶使用前用含硫酸的溶液润洗了
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.(6分)实验室配制1mol/L Na2CO3溶液250mL。
(1)需要固体Na2CO3 g;
(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 mL;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)用固体Na2CO3配制该溶液的操作顺序是(用字母表示,不重复使用) 。
A.称量 B.洗涤 C.定容 D.溶解 E.摇匀 F.转移
(6)没有洗涤这步操作,所配制的溶液浓度 (填偏大、偏小或无影响)
Ⅱ.(4分) 在25℃、101kPa条件下,将15L O2通往10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中,V(CO)= L,V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中,V(CO): V(H2)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com