

分析 废液中含Fe3+、Cu2+和Ag+三种阳离子.操作a中加入过量的铁屑,由于铁的化学性质比铜银活泼,因此可以把金属铜和银从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在操作a得到的滤渣中都含有金属铜、银和过量的铁,分离固体和溶液需要过滤分离,滤液中加入氧化剂过氧化氢溶液氧化亚铁离子为铁离子,加入强碱溶液后生成氢氧化铁沉淀,过滤得到可排放废液,
解答 解:废液中含Fe3+、Cu2+和Ag+三种阳离子.操作a中加入过量的铁屑,由于铁的化学性质比铜银活泼,因此可以把金属铜和银从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在操作a得到的滤渣中都含有金属铜、银和过量的铁,分离固体和溶液需要过滤分离,滤液中加入氧化剂过氧化氢溶液氧化亚铁离子为铁离子,加入强碱溶液后生成氢氧化铁沉淀,过滤得到可排放废液,
(1)方案中,操作a 为过滤,所用到的玻璃仪器有漏斗、玻璃棒、烧杯,加入试剂2为氢氧化钠溶液,反应后生成红褐色沉淀,
故答案为:漏斗、玻璃棒、烧杯;生成红褐色沉淀;
(2)方案中,试剂1 应选用的物质是过量的铁粉,由于铁的化学性质比铜银活泼,因此可以把金属铜和银从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在操作a得到的滤渣中都含有金属铜、银和过量的铁,加入试剂1 后得到的“沉淀”的成分是:Fe、Ag、Cu,
故答案为:Fe;Fe、Ag、Cu.
点评 本题考查了金属的回收与环境保护,题目难度中等,注意掌握金属回收方法、常见的离子之间的反应,明确离子方程式的书写方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH | B. | HOOC-COOH | C. | 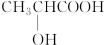 | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向AlCl3溶液中滴加过量NaOH溶液 | 溶液澄清 | Al3+与NaOH能大量共存 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
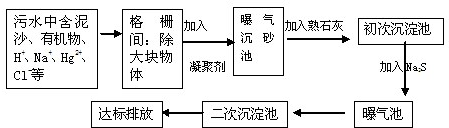
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 取少量溶液依次加入BaCI2溶液和稀盐酸产生白色沉淀,则原溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s23p8 | B. | 3d10 | C. | 3s23p64s2 | D. | 3s23p63d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | 20 | 不加 | 20 | 20 | 2.0050 | ﹨ |
| ④ | t2 | 5mL0.01mol•L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
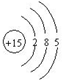 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )| A. | 第3周期,第ⅢA族 | B. | 第5周期,第ⅤA族 | C. | 第5周期,第ⅢA族 | D. | 第3周期,第ⅤA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com