
����Ŀ������A��B��C��D���ֶ����ڷǽ���Ԫ�أ����ǵ�ԭ������������֮��Ϊ19�������ǵĻ������У���Ҫ���ϼ۾���ֹһ�֣�����һ����ͬ�Ļ��ϼۣ����ǵIJ����������£�
Ԫ�� | A | B | C | D |
ԭ�Ӱ뾶/nm | 0.102 | 0.077 | 0.117 | 0.075 |
��������ϼ� | ��4 | +4 |
��1��AԪ����Ԫ�����ڱ��е�λ��Ϊ ��
��2����DԪ�ص����ֳ������ۻ���������Ϸ�Ӧ������һ�����ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��B�ĵ�����D������������Ӧ��ˮ�����ڼ��������·�����Ӧ�Ļ�ѧ����ʽΪ ��
��4��C������Al����ijЩ�����ԣ���������ǿ�Ӧ��д��C������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��5��A��B��C��D�����γɷ����к�18���ӵ��⻯���Щ�⻯��ķ���ʽ�ֱ�Ϊ ��
���𰸡�
��1���������ڢ�A��
��2��NH3+HNO3�TNH4NO3
��3��C+4HNO3��Ũ�� ![]() ?4NO2��+CO2��+2H2O
?4NO2��+CO2��+2H2O
��4��Si+2NaOH+H2O�TNa2SiO3+2H2��
��5��H2S��C2H6��SiH4��N2H4
���������⣺������Ԫ���У�B������۩�4��C���������+4�����ߴ���IVA�壬��C��ԭ�Ӱ뾶��B�Ĵ�BΪ̼Ԫ�ء�CΪSi����Ԫ��ԭ������������֮��Ϊ19����A��Dԭ�ӵ�����������֮��Ϊ19��4��4=11����֪A��D������������ֻ����5��6����ԭ�Ӱ뾶A��Si��̼��D������Ԫ�ؾ�����ͬ�Ļ��ϼ�ӦΪ+4�ۣ���֪AΪSԪ�ء�DΪNԪ�أ�
��1.��AΪSԪ�أ���Ԫ�����ڱ��е�λ��Ϊ���������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻
��2.����NԪ�ص����ֳ������ۻ���������Ϸ�Ӧ������һ�����ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ��NH3+HNO3�TNH4NO3 �� ���Դ��ǣ�NH3+HNO3�TNH4NO3��
��3.��D������������Ӧ��ˮ����Ϊ���ᣬ̼����Ũ�����ڼ��������·�����Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3��Ũ�� ![]() 4NO2��+CO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ��
4NO2��+CO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ�� ![]() 4NO2��+CO2��+2H2O��
4NO2��+CO2��+2H2O��
��4.��Si��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��Si+2NaOH+H2O�TNa2SiO3+2H2�������Դ��ǣ�Si+2NaOH+H2O�TNa2SiO3+2H2����
��5.����̼���衢�������γɷ����к�18���ӵ��⻯���Щ�⻯��ķ���ʽ�ֱ�Ϊ��H2S��C2H6��SiH4��N2H4 �� ���Դ��ǣ�H2S��C2H6��SiH4��N2H4 ��


 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������,�����ں����ܱ������н��еķ�Ӧ:2SO2(g) +O2(g)2SO3(g), ���������ܳ��˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����( )
A.�����淴Ӧ���ʶ�������B.SO2��O2��SO3��Ũ�����
C.SO2��O2��SO3�������й���D.SO2��O2��SO3��Ũ�Ⱦ����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������������ﵫ������ˮ���ǣ� ��
A.��������
B.��������
C.��������
D.������̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g),��Ӧ�������¡�
2P(s)+3Cl2(g)=2PCl3(g) ��H=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ��H=-798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ________.
��2����ͬ�¶��·�ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H1��ƽ�ⳣ�����±���ʾ��
CO2(g)+H2(g) ��H1��ƽ�ⳣ�����±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����H1______0(����<����>��)����500��ʱ���ѵ����ʵ���Ũ�ȵ�CO��H2O(g)���뷴Ӧ�������ﵽƽ��ʱc(CO)=0.005mol/L��c(H2)=0.015mol/L,��CO��ƽ��ת����Ϊ______��
��3����һ������ľ����ܱ������У����ڷ�Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H<0,�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_____________��
2SO3(g) ��H<0,�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_____________��
A.SO2��SO3Ũ�����
B.�����л��������ܶȱ��ֲ���
C.������������¶ȱ��ֲ���
D.SO3������������SO2�������������
���¶�ΪT1��T2ʱ��ƽ����ϵSO3�����������ѹǿ�仯��������ͼ��ʾ����T1____T2 (����>������<")��������_____�������ӿ�����Ӧ�����ʣ����˸ı��¶ȣ���������_______������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ36��Ԫ���е�A��B��C��D��E��F��ԭ��������������ֻ��ǰ����Ϊ������Ԫ�ء�A��B��ԭ�Ӻ���s����������p�����������: Cԭ�Ӻ�������p���ȫ�������: DԪ�ص����������������IJ�Ϊ4;E��ǰ�������е縺����С��Ԫ��:F�����ڱ��ĵ���������������������Ϣ���ش���������.
��1��A���ӵĵ��ӹ�ռ��_____�������AԪ������Ȼ���еĴ�����̬_____(a ֻ�л���̬��bֻ������̬��c������)��
��2��ij�˻���B�ĵ����Ų�ͼ��ͼ![]() ��Υ����________ԭ����
��Υ����________ԭ����
��3��Fλ��______�壬���̬ԭ�ӵĵ�����_____���˶�״̬��
��4��CD3����ԭ�ӵ��ӻ���ʽΪ____���ü۲���ӶԻ��������Ʋ�����ӿռ乹��Ϊ____������EԪ�صķ�����___________��
��5����ij�������ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ����Ʒ��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ.���и�ԭ�ӵ���λ��Ϊ______���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ���ֻ����ѻ���ʽ�е�________������֪�ý�����ԭ�Ӱ뾶Ϊdcm,NA���������ӵ����������������ԭ������ΪM,��þ�����ܶ�Ϊ________g/cm3(����ĸ��ʾ)��
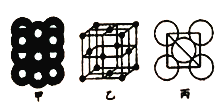
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵���
ʵ�� | ���� | ���� | |
A | ��2mL0.1mol��L-1��FeCl3��Һ�м��������ۣ�����1��KSCN��Һ | ��ɫ������ʧ����KSCN��Һ��ɫ���� | ��ԭ�ԣ�Fe>Fe2+ |
B | ����������ȼ�ճ��е�ȼ��Ѹ�����뼯��CO2�ļ���ƿ | ����ƿ�в����������̣�ƿ���к�ɫ�������� | CO2���������� |
C | ����ʢ����NH4HCO3������Թܣ������Թܿڷ���ʪ��ĺ�ɫʯ����ֽ | ʯ����ֽ���� | NH4HCO3�Լ��� |
D | ��2֧ʢ��2mL��ͬŨ��������Һ���Թ��зֱ����2����ͬŨ�ȵ�NaCl��NaI��Һ | һֻ�Թ��в�����ɫ��������һ֧������������ | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ����С���ͬѧ����ɿα��Ҵ���������ȩ��ʵ��Ľ���ʵ�鷽������ͼ������������ʵ�������˳���Ѵ�������
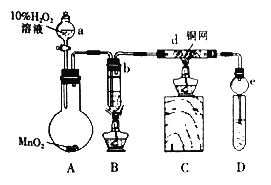
�ٵ�ȼBװ���еľƾ��Ƽ�����ˮ�Ҵ������ڲ��������ȣ�
����Բ����ƿ�еμ�10%����������Һ��
�����Ӻ�����������װ�õ������ԣ�
����ȷ�����Լ���
�ݵ�ȼCװ���еľƾ���
��������ʵ�����ݻش��������⣺
��1��ʵ�����˳���� _____________________�����������
��2��װ��e��������_____________________________________��
��3��д��d�з�����Ӧ�Ļ�ѧ����ʽ____________________________________________��
��4��Ϊ����D���ռ��IJ������Ƿ�����ȩ����ͬѧ����������Һ���飬��д����ѧ����ʽ_________________________________________________________��
��5����ͬѧ��һ֧�Թ����ȼ���2mL5%��CuSO4���μ�4��5��NaOH��Һ���ٵμӼ���D����Һ���ھƾ����ϼ��ȣ�δ����ש��ɫ�������Ӷ��϶�����ȩ���ɣ������ж���ͬѧ��˵���Ƿ��������˵������___________________________________________________��
��6�����Թ����ռ�����Һ������ɫʯ����Һ���飬��Һ�Ժ�ɫ��˵��Һ���л�����____��Ҫ��ȥ�����ʣ������ڻ��Һ�м���_____����д����ѡ���е���ĸ����Ȼ����ͨ��_____����������������ɳ�ȥ��
A������NaCl��Һ B��C2H5OH C��NaHCO3��Һ D��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������᳧����(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ�����(��ʽ�������ľۺ���)���̷�(FeSO4��7H2O)����������£�
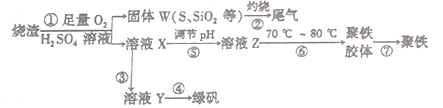
��1�����̢��У���Ҫ���������������____________________��
��2�����̢��в�����β����Դ��������Ⱦ����ѡ�������Լ��е�___________������
a.Ũ���� b.����ˮ c.NaOH��Һ d.Ũ����
��3�����̢�����FeS��O2��H2SO4��Ӧ�Ļ�ѧ����ʽΪ____________________��
��4�����̢ܵ�ʵ�������____________________��
��5�����̢���������ҺZ���ȵ�70����80����Ŀ���� ___________________��
��6��ij���������������н���������������һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ������������е�SO2��NO2�����ʵ���֮��Ϊ1��1����÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
��7��ʵ����Ϊ�ⶨ���õ��ľ�����Ʒ����Ԫ�ص�������������������ʵ�顣���÷�����ƽ��ȡ��Ʒ2.700 g���ڽ���Ʒ����������������������Ȼ�����Һ���۹��ˡ�ϴ�ӡ�����������ù�������Ϊ3.495g�����þ�����Ҫ�ɷ�Ϊ[Fe(OH)SO4]a����þ�������Ԫ�ص���������Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100mL1mol/Lϡ���ᣬ������Ũ�ȱ�Ϊ2mol/L�����Բ�ȡ�Ĵ�ʩΪ�� ��
A. ������ͨ������22.4LHCl���� B. ��������ʹ��Һ�����Ϊ50mL
C. ����������50mLˮ D. ����5mol/L����100mL���ٽ���Һ���ϡ�͵�300mL
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com