
分析 30秒反应达到平衡,此时M的转化率为60%,则
M(g)+N(g)?P(g)+Q(g)
开始 2 4.8 0 0
转化 1.2 1.2 1.2 1.2
平衡 0.8 3.6 1.2 1.2
(1)结合v=$\frac{△c}{△t}$计算;
(2)K为生成物浓度幂之积与反应物浓度幂之积的比;
(3)温度不变,则K不变,则
M(g)+N(g)?P(g)+Q(g)
开始 4 a 0 0
转化 2 2 2 2
平衡 2 a-2 2 2
$\frac{2×2}{2×(a-2)}$=K,以此来解答.
解答 解:30秒反应达到平衡,此时M的转化率为60%,则
M(g)+N(g)?P(g)+Q(g)
开始 2 4.8 0 0
转化 1.2 1.2 1.2 1.2
平衡 0.8 3.6 1.2 1.2
(1)30秒内,用Q浓度的表示反应速率v=$\frac{\frac{1.2mol}{2L}}{30s}$=0.02mol/(L.s),
答:用Q浓度的表示反应速率为0.02mol/(L.s);
(2)上述温度下,该反应的化学平衡常数K=$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×1.8mol/L}$=0.5,
答:上述温度下,该反应的化学平衡常数为0.5;
(3)温度不变,则K不变,则
M(g)+N(g)?P(g)+Q(g)
开始 4 a 0 0
转化 2 2 2 2
平衡 2 a-2 2 2
$\frac{2×2}{2×(a-2)}$=0.5,解得a=6,
答:a的值为6.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法,K及速率的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.


科目:高中化学 来源: 题型:选择题
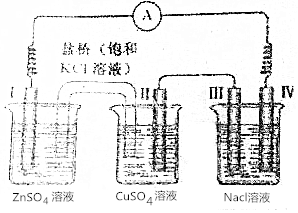
| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定:B>C | |
| B. | 简单离子的半径:D>C | |
| C. | 最高氧化物对应的水化物的酸性:B>D | |
| D. | BC2、D2C3中化学键类型相冋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定含有Fe3+和Fe2+,肯定没有Cu2+ | |
| B. | 肯定含有Fe3+,肯定没有Cu2+,可能含Fe2+ | |
| C. | 肯定含有Cu2+,肯定没有Fe3+,可能含有Fe2+ | |
| D. | 肯定含有Fe2+,肯定没有Fe3+,可能含有 Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.044mol/L | B. | 0.44mol/L | C. | 4.4mol/L | D. | 44mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,c(Z)=0.24 mol•L-1 | |
| D. | 该温度下此反应的平衡常数:K=1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com