
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
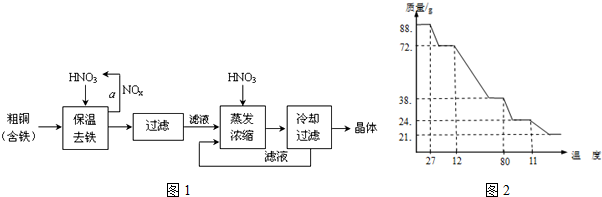
分析 (1)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体,
①氮氧化物和氧气、水反应生成硝酸,提高原料利用率;
②调节溶液的pH使氢氧化铁完全沉淀,铜离子不产生沉淀,据此判断溶液的pH;加入的物质不能引进新的杂质,且要将铁离子转化为沉淀,增大溶液的pH;
③酸性条件下能抑制铜离子水解;
(2)①根据图象可知,当温度27℃<T<120℃时,硝酸铜晶体【Cu(NO3)2.6H2O】部分失去结晶水;
②根据上述分析,当温度27℃<T<120℃时,生成物为Cu(NO3)2•3H2O,剩余固体质量38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,又因为此温度下HNO3也分解,所以当温度120℃<T<800℃时,反应的化学方程式为3Cu(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O;
③根据纵坐标的数据关系;
(3)Cu与液态N2O4反应,反应过程中有无色气体放出,遇到空气变红棕色,说明生成物有NO.
解答 解:(1)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体,
①氮氧化物有毒,且NO不和水反应,通入氧气和水,氮氧化物和氧气、水反应生成硝酸,硝酸能循环利用,从而提高原料利用率,且减少污染物的排放,
故答案为:将NOx转化为硝酸,提高原料的利用率,减少污染物的排放;
②调节溶液的pH使氢氧化铁完全沉淀,铜离子不产生沉淀,当溶液的pH在1.9~3.2之间,铁离子沉淀,而铜离子不产生沉淀,pH为4.7时铜离子产生沉淀,所以调节溶液的pH为3.2--4.7;
故答案为:3.2--4.7;
③铜离子水解生成氢氧化铜和氢离子,水解方程式为Cu2++2H2O?Cu(OH)2+2H+,加入稀硝酸能抑制硝酸铜溶解,
故答案为:抑制加热过程中Cu2+的水解;
(2)①根据图象可知,当温度27℃<T<120℃时,硝酸铜晶体【Cu(NO3)2.6H2O】部分失去结晶水,该反应的化学方程式为Cu(NO3)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•3H2O+3H2O↑
故答案为:Cu(NO3)2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•3H2O+3H2O;
②根据上述分析,当温度27℃<T<120℃时,生成物为Cu(NO3)2•3H2O,剩余固体质量38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,又因为此温度下HNO3也分解,所以当温度120℃<T<800℃时,反应的化学方程式为3Cu(NO3)2•3H2O=Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O,
故答案为:3Cu(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2•2Cu(OH)2+4NO2↑+O2↑+7H2O;
③根据纵坐标的数据关系,当剩余固体质量为21.6g时,固体的化学式为Cu2O;
故答案为:Cu2O
(3)Cu与液态N2O4反应,反应过程中有无色气体放出,遇到空气变红棕色.反应的化学方程式是Cu+2 N2O4=Cu(NO3)2+2NO↑,
故答案为:Cu+2 N2O4=Cu(NO3)2+2NO↑.
点评 本题以铜和酸的反应为载体考查混合物的分离和提纯,根据物质的性质、基本操作从整体上分析流程图中各个步骤发生的反应,知道图2中曲线上、下区域表示的含义,注意盐类水解的影响因素,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | |
| D. | 锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
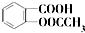 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.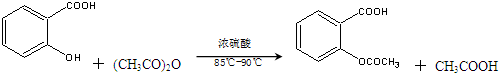
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
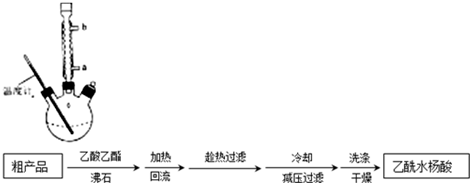
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
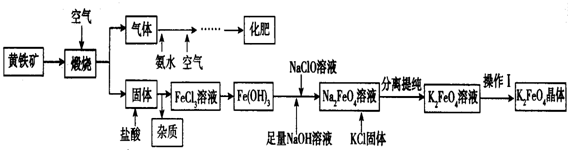
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
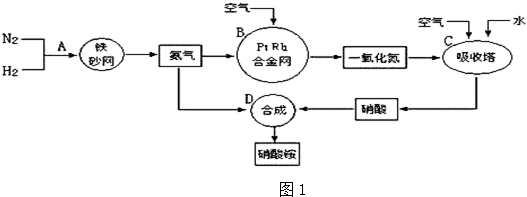
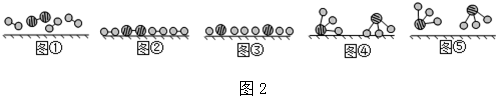
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
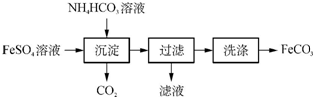
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
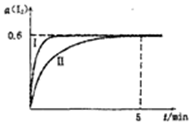 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com