
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2015-2016学年辽宁省分校高一下学期6月月考化学试卷(解析版) 题型:选择题
在某容积一定的密闭容器中,可逆反应A ( g ) + B ( g ) x C ( g ),符合下图(I)所示关系,由此推断对图(II)的正确说法是( )
x C ( g ),符合下图(I)所示关系,由此推断对图(II)的正确说法是( )
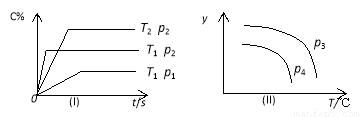
A.p3 <p4,Y轴表示A的转化率
B.p3 > p4,Y轴表示混合气体的密度
C.p3 <p4,Y轴表示B的浓度
D. p3 > p4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一下第二阶段考试化学试卷(解析版) 题型:选择题
化学与环境、材料、信息、能源关系密切,下列说法正确的是 ( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下第二阶段考试化学试卷(解析版) 题型:选择题
下列系统命名法正确的是( )
A. 2-甲基-4-乙基戊烷
B. 2,3-二乙基-1-戊烯
C.2-甲基-3-丁炔
D.对二甲苯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省协作体高二下学期第一次联考化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因 ;
溶液中离子浓度由大到小的顺序为
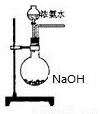
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 。
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省协作体高二下学期第一次联考化学试卷(解析版) 题型:选择题
常温,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中: I-、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下学科竞赛化学试卷(解析版) 题型:实验题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
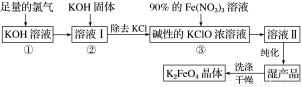
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式:________________________。
(2)在溶液Ⅰ中加入KOH固体的目的是____________(填字母)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________________________________________________。每制得59.4 g K2FeO4,理论上消耗氧化剂的物质的量为________ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:______ FeO42-+______ H2O===______ Fe(OH)3(胶体)+______ O2↑+______ OH-。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下学科竞赛化学试卷(解析版) 题型:选择题
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A.Na2CO3和Na2O2 B.Na2CO3和NaOH
C.NaOH和Na2O2 D.NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下十一次联考化学试卷(解析版) 题型:选择题
食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.步骤(2)产物中残留的烯丙醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com