
| A. | 混合气体的颜色不再变化 | |
| B. | O2、NO、NO2三种物质的反应速率之比为1:2:2 | |
| C. | 反应混合物中各组分物质的浓度相等 | |
| D. | 混合气体的密度不再改变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、混合气体的颜色不再变化,说明二氧化氮的浓度不变,正逆反应速率相等,达平衡状态,故A正确;
B、从反应的开始反应速率之比就符合1:2:2,故B错误;
C、平衡时反应混合物中各组分物质的浓度不变,而不是相等,故C错误;
D、混合气体的密度起终不随时间的改变而改变,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2所含原子数目为NA | |
| B. | 1mol铁与足量盐酸反应,转3mol电子 | |
| C. | 1L0.5mol•L-1Al2(SO4)3溶液中,Al3+的浓度为1.0mol•L-1 | |
| D. | 1.8g NH4+所含的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | c(H+)═10-7mol/L | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$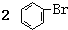 | |
| D. | 将CO2通入苯酚钠溶液: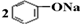 +CO2+H2O→ +CO2+H2O→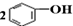 +Na2CO3 +Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的原子,其核外电子排布也相同 | |
| B. | 质量数相同的不同原子,其化学性质一定相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数是24 | |
| B. | 原子半径比硫原子的原子半径大 | |
| C. | 最高价氧化物是SeO3,是酸性氧化物 | |
| D. | 气态氢化物化学式是H2Se,还原性比HCl强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol•L-1 | B. | 2mol•L-1 | C. | 2.5mol•L-1 | D. | 3mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com