
【题目】N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第周期第族;Na和O形成1:1的化合物的电子式: . 该物质含有的化学键为: .
(2)用“>”或“<”填空:
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣Mg2+ | SO3 | H﹣O |
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr ![]() 3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:
(4)已知N4为正四面体结构,N﹣N键能为167kJmol﹣1 , N≡N键能为942kJmol﹣1 . 写出N4(g)转化为N2(g)的热化学方程式 . 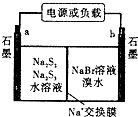
【答案】
(1)四;VIIA;![]() ;离子键和非极性键
;离子键和非极性键
(2)<;>;<;>
(3)b;3S22﹣﹣2e﹣=2S32﹣
(4)N4(g)=2N2(g)△H=﹣882kJ/mol
【解析】解:(1)主族元素原子电子层数与其周期数相等,最外层电子数与其族序数相等,Br原子核外有4个电子层、最外层电子数是7,所以位于第四周期第VIIA族;Na和O形成1:1的化合物是过氧化钠,其电子式为 ![]() ,过氧化钠中存在离子键和非极性键, 所以答案是:四;VIIA;
,过氧化钠中存在离子键和非极性键, 所以答案是:四;VIIA; ![]() ;离子键和非极性键;(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性N<O,所以稳定性NH3<H2O;
;离子键和非极性键;(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性N<O,所以稳定性NH3<H2O;
电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径O2﹣>Mg2+;
离子晶体熔沸点大于分子晶体,三氧化硫是分子晶体、过氧化钠是离子晶体,所以熔点SO3<Na2O2;
非金属性元素非金属性越强,其吸引电子能力越强,则键的极性越强,非金属性O>N,则键的极性H﹣O>H﹣N;
所以答案是:<;>;<;>;(3)①放电时,溴电子发生还原反应,则a是负极、b是正极,电解质溶液中阳离子向正极移动,所以向b电极移动,所以答案是:b;
②放电时,负极上失电子发生氧化反应,电极反应式为3S22﹣﹣2e﹣=2S32﹣ , 所以答案是:3S22﹣﹣2e﹣=2S32﹣;(4)该反应焓变=反应物键能﹣生成物键能=6×167kJ/mol﹣2×942kJ/mol=﹣882kJ/mol,则该反应热化学方程式为N4(g)=2N2(g)△H=﹣882 kJ/mol,所以答案是:N4(g)=2N2(g)△H=﹣882 kJ/mol.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】在①二氧化碳②二氧化硫③氟氯烃中,造成酸雨的主要因素是______含量的增加;全球气候变暖是由于______含量的急剧增加;造成臭氧空洞的主要物质是______(以上均要求填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的二种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1mol
D.同温下,体积相同的两容器分别充2 g Y气体和1g Z气体,则其压强比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH3 0.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示.已知甲、乙两室中气体的质量差为17.3g.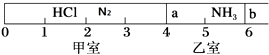
(1)甲室中气体的质量为 .
(2)甲室中HCl、N2的物质的量之比为 .
(3)将隔板a去掉,当HCl与NH3充分反应生成NH4Cl固体后(仅发生此反应),隔板b将位于刻度“”处(填数字,不考虑固体物质产生的压强),此时体系的平均摩尔质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4﹣ , HSO4﹣![]() H++SO42﹣ .
H++SO42﹣ .
请回答下列有关问题:
(1)Na2SO4溶液呈(填“弱酸性”、“中性”或“弱碱性”),其理由是(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为:
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
A.c(SO42﹣)+c(HSO4﹣)+c(H2SO4)=0.1mol/L
B.c(OH﹣)=c(H+)+c(HSO4﹣)
C.c(Na+)+c(H+)=c(OH﹣)+c(HSO4﹣)+2c(SO42﹣)
D.c(Na+)>c(SO42﹣)>c(OH﹣)>c(HSO4﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~J分别代表相关反应的一种物质,图中有部分生成物未标出.
已知:A分解得到等物质的量的B,C,D;反应①为:2Mg+CO2 ![]() 2MgO+C.
2MgO+C.
(1)A的化学式 .
(2)写出反应②的化学方程式: .
(3)写出反应③的离子方程式: .
(4)写出反应⑤的化学方程式: .
(5)在反应④中,当生成标准状况下2.24L G时,转移电子mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com