
分析 (1)根据S元素守恒n(CaSO4•2H2O)=n(SO2),再根据m=nM计算石膏的质量;
(2)令混合气体中NO2、NO的物质的量分别为xmol、ymol,结合混合气体的体积及消耗的氧气的体积列方程计算;
(3)①依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
②依据氧化还原反应的电子守恒计算ZnFe2Oz中Fe元素化合价,根据化合价确定+2Fe与+3价Fe的原子数目之比,据此书写氧化物氧化物形式的化学式;
再根据化合物中的元素化合价代数为0计算z的值,据此改写;
(4)由反应①②可知,O3在氧化过程中都生成O2,则NOx与O3在水蒸气存在下反应时有如下关系:2NOx+(5-2x)O3+H2O→2HNO3+(5-2x)O2,设烟气为1m3,其中NOx为4.5L,SO2为9L,则V(O3)=90y,由反应④可知,与SO2反应的O3为9L,故与NOx反应的O3为(90y-9)L为,再根据上述方程式计算.
解答 解:(1)根据S元素守恒n(CaSO4•2H2O)=n(SO2)=1.5mol,故石膏的质量为1.5mol×172g/mol=258g,
故答案为:258;
(2)11.2L NO2、NO的混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5L,4.48L的CH4的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,令混合气体中NO2、NO的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.5\\;\\;}\\{\frac{1}{2}x+\frac{1}{4}y=0.2}\end{array}\right.$解得:x=0.3,y=0.2,
故答案为:0.3 mol、0.2 mol;
(3)①2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:3;
②1molZnFe2Oz最多能使4.0L(标况)NO1.4转化为N2,则ZnFe2Oz被还原为ZnFe2O4,令ZnFe2Oz中铁元素的化合价为b,根据电子转移守恒,可知1mol×2×(3-b)=$\frac{4L}{22.4L/mol}$×2.8,解得b=2.75,令+2Fe与+3价Fe的原子数目之比为m:n,根据平均化合价,则2m+3n=2.75m+2.75n,整理得m:n=1:3,氧化物化学式为aZnO•2FeO•3Fe2O3,化学式中n(Fe)=2n(Zn),故a=4,即氧缺位铁酸锌ZnFe2Oz的氧化物形式为4ZnO•2FeO•3Fe2O3,故答案为:4ZnO•2FeO•3Fe2O3;
(4)由反应①②可知,O3在氧化过程中都生成O2,则NOx与O3在水蒸气存在下反应时有如下关系:2NOx+(5-2x)O3+H2O→2HNO3+(5-2x)O2,设烟气为1m3,其中NOx为4.5L,SO2为9L,则V(O3)=90y,由反应④可知,与SO2反应的O3为9L,故与NOx反应的O3为(90y-9)L为,则:
2NOx~(5-2x)O3
2 5-2x
4.5 90y-9
所以有2:4.5=(5-2x):(90y-9),整理得y=0.225-0.05x
答:y与x的关系式为y=0.225-0.05x.
点评 本题以消除NOx污染治理为载体,考查混合物有关计算、氧化还原反应计算、根据方程式的计算等,题目计算量较大,数据繁琐,是对学生心理素质的考验,难度较大,为易错题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤 | B. | 萃取 | C. | 分液 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为NH3的水溶液可以导电,所以NH3是电解质 | |
| B. | 因为O2可以与CO反应生成CO2,所以可以用O2除去CO2中的杂质CO | |
| C. | 因为液态HCl不导电,所以HCl是非电解质 | |
| D. | 因为氢氧化铁胶体具有吸附性,所以常用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径大小顺序:r(Z2+)>r(Y2-) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L 水中所含的电子数为NA | |
| B. | 常温常压下,16 g O3所含的原子数为NA | |
| C. | 0.1 mol Na2O2 晶体中所含的离子数为0.4NA | |
| D. | 1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
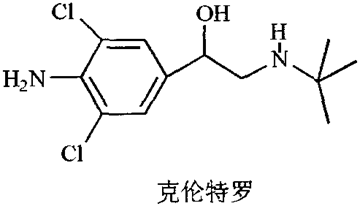
| A. | 它的分子式为C12H18N2Cl2O | |
| B. | 它含有氨基、氯原子等官能团 | |
| C. | 1mol克伦特罗最多能和3 molH2发生加成反应 | |
| D. | 一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com