
0.1 mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)
C.c(OH-)>c(HF) D.c(HF)>c(F-)
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
某电镀铜厂有两种废水需要处理,一种废水中含有CN-,另一种废水中含有Cr2O 。该厂拟定如图所示的废水处理流程。
。该厂拟定如图所示的废水处理流程。
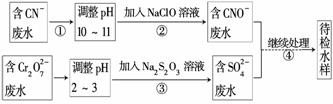
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是___ _____________________________________________________________________。
_____________________________________________________________________。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________________________________________________________________。
(3)②中反应后无气体放出,该反应的离子方程式为
________________________________________________________________________。
(4)③中反应时,每0.4 mol Cr2O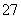 转移2.4 mol e-,该反应的离子方程式为________________________________________________________________________。
转移2.4 mol e-,该反应的离子方程式为________________________________________________________________________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中的固体剩余物是( )
A.Na2CO3和Na2O2
B.Na2CO3和NaOH
C.NaOH和Na2O2
D.NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知丙二醇的结构简式为 ,下列关于丙二醇的说法正确的是( )
,下列关于丙二醇的说法正确的是( )
A.丙二醇可发生消去反应生成丙炔
B.丙二醇可由丙烯在一定条件下与水加成制得
C.丙烯与溴水加成后,再与NaOH醇溶液共热水解可得丙二醇
D.丙二醇在铜存在下催化氧化可得到丙二醛
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1 mol分子式为C3H8O的液体有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A的分子式必有一个__________基。若A分子中只有一个—CH3,完成(2)(3)中的填空:
(2)A与浓硫酸共热,分子内脱去1分子水,生成B。B的结构简式为__________。B通入溴水能发生__________反应生成C,C的结构简式为__________。A在有铜作催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为__________。
(3)写出下列反应的化学方程式:
①A―→B_____________________________________________;
②B―→C_____________________________________________;
③A―→D_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
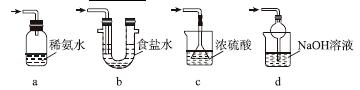
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
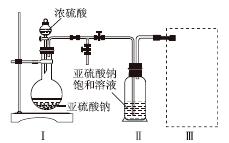
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
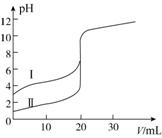
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选 项 | ① | ② | ③ | 实验结论 |
|
| A. | 稀 硫 酸 | Na2S | AgNO3与 AgCl的 浊液 | Ksp(AgCl)> Ksp(Ag2S) | |
| B. | 浓 硫 酸 | 蔗糖 | 溴水 | 浓硫酸具有脱 水性、氧化性 | |
| C. | 稀 盐 酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性 钡盐均可生成 白色沉淀 | |
| D. | 浓 硝 酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸> 碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述中,正确的是( )
A.苯酚呈弱酸性,能使石蕊试液显浅红色
B.苯酚分子中的13个原子有可能处于同一平面上
C.苯酚有强腐蚀性,沾在皮肤上可用酒精洗涤
D.苯酚能与FeCl3溶液反应生成紫色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com