
分析 (1)根据题意可知,氢气在氯气中燃烧时,氯气过量,故和氢氧化钠反应的是HCl和过量的氯气;
(2)m(NaOH)=n(NaOH)×M(NaOH),m(溶液)=vρ,根据质量分数=$\frac{溶质的质量}{溶液的质量}$计算;
(3)根据电荷守恒计算;
(4)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,根据质量守恒计算.
解答 解:(1)根据题意可知,氢气在氯气中燃烧时,氯气过量,故和氢氧化钠反应的是HCl和过量的氯气,离子方程式为:H++OH-=H2O,Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:H++OH-=H2O,Cl2+2OH-=Cl-+ClO-+H2O;
(2)m(NaOH)=n(NaOH)×M(NaOH)=0.1L×3mol/L×40g/mol=12g,
m(溶液)=vρ=100mL×1.12g/mL=112g,
则ω(NaOH)=$\frac{12g}{112g}$×100%=10.71%,
故答案为:10.71%;
(3)所得溶液中为NaCl和NaClO的混合物,根据电荷守恒可知n(Na+)=n(Cl-)+n(ClO-),
则n(Cl-)=n(Na+)-n(ClO-)=0.3mol-0.05mol=0.25mol,
故答案为:0.25;
(4)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,
涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,
与H2反应的Cl2为n(Cl2)=$\frac{1}{2}$×[n(Cl-)-n(NaClO)]=$\frac{1}{2}$×(0.25mol-0.05mol)=0.1mol=n(H2),
则所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=(0.1mol+0.05mol):0.1mol=3:2,
故答案为:3:2.
点评 本题考查较为综合,侧重于学生计算能力和分析能力的考查,注意判断反应的程度以及相关方程式的书写,从质量守恒的角度解答该题.


科目:高中化学 来源: 题型:解答题
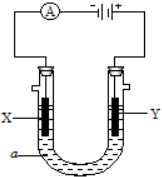 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
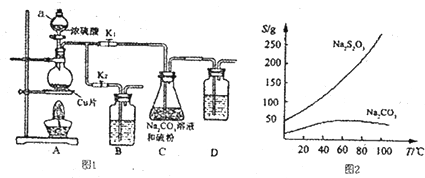
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,需重新配制 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 焰色反应是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解结束后,阴极室溶液的pH与电解前相比将变大 | |
| B. | 若用铅蓄电池作该装置的供电电源,B接线柱应连接Pb | |
| C. | 涉及除去尿素的反应为CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl | |
| D. | 若通电一段时间后,电路中通过的电量是77.06×104C,则有8NA个H+通过质子交换膜 (一个电子所带的电量为1.6×10-19C) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高臭氧浓度以改善空气质量 | B. | 提升矿物燃料的脱硫脱硝技术 | ||
| C. | 研发太阳能汽车代替燃油汽车 | D. | 开发不含氮、磷的洗涤清洁剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
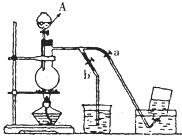 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2(FeCl3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | NaCl(MgCl2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com