
【题目】A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1mol C能与2mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同;D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B或E生成CO2的量相同。
(1)试确定A、B、C、D、E的结构简式:
A:_____;B:_____;C:_____;D:_____;E:_____。
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是______(填名称,下同)生成二氧化碳最多的是______。
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是____(填名称,下同),生成水最多的是______。
【答案】 CH≡CH CH2=CH2 CH2=CHCH=CH2 CH4 CH3CH3 甲烷 乙炔 1,3﹣丁二烯 1,3﹣丁二烯和乙烷
【解析】试题分析:气态烃,碳原子数小于等于4,A、B、C都能使酸性高锰酸钾溶液褪色,说明含有碳碳双键或碳碳叁键;1mol C能与2mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子,说明C含有2个碳碳双键,C是1,3-丁二烯;B与相同条件下N2的密度相同,B的相对分子质量是28,B是乙烯;A与H2加成可得B,A与C具有相同的通式,A是乙炔; D是最简单的有机物,D是甲烷;E是D的同系物,完全燃烧相同物质的量的B或E生成CO2的量相同,说明B、E分子中碳原子数相同,E是乙烷。(2)等质量的烃完全燃烧,氢元素质量分数越高,耗氧量越多,生成二氧化碳越少;(3)等物质的量的烃完全燃烧, ![]() 越大,耗氧量越多,
越大,耗氧量越多, ![]() 越大生成水越多;
越大生成水越多;
解析:根据以上分析,(1)A是乙炔,结构简式是CH≡CH;B是乙烯,结构简式是CH2=CH2;C是1,3-丁二烯,结构简式是CH2=CHCH=CH2;D是甲烷,结构简式是CH4;E是乙烷,结构简式是CH3CH3;
(2)CH≡CH、 CH2=CH2 、CH2=CHCH=CH2 、 CH4 、CH3CH3氢元素的质量分数分别是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,等质量的烃完全燃烧,氢元素质量分数越高,耗氧量越多,等质量的A、B、C、D、E完全燃烧,耗氧量最多的是甲烷,氢元素质量分数越小,生成二氧化碳越多,所以生成二氧化碳最多的是乙炔。
,等质量的烃完全燃烧,氢元素质量分数越高,耗氧量越多,等质量的A、B、C、D、E完全燃烧,耗氧量最多的是甲烷,氢元素质量分数越小,生成二氧化碳越多,所以生成二氧化碳最多的是乙炔。
(3)等物质的量的烃完全燃烧, ![]() 越大,耗氧量越多,等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是1,3﹣丁二烯,
越大,耗氧量越多,等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是1,3﹣丁二烯, ![]() 越大生成水越多,生成水最多的是1,3﹣丁二烯和乙烷。
越大生成水越多,生成水最多的是1,3﹣丁二烯和乙烷。


科目:高中化学 来源: 题型:
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g)![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(H2)=_____________mol·L-1·min-1。
②相对a而言,b可能改变的条件是________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注。_____________
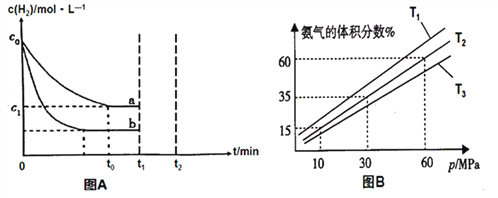
(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1__________T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时N2的平衡分压为_______MPa(分压=总压×物质的量分数);列式表示此时的平衡常数Kp=______________。(用平衡分压代替平衡浓度,不要求计算结果)
(3)有人利用NO2和NH3构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铜精炼,如图C所示,d极为粗铜。
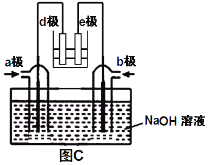
① a极通入________(填化学式);
② b极电极反应为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应: N2O4(g)![]() NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。
NO2(g)ΔH>0,其N2O4和NO2浓度变化如图。

(1)在0-60s这段时间内,以N2O4表示的平均反应速率为_______mol·L-1·s-1
(2)上述反应的平衡常数表达式为______,升高温度K值______ (填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是______ (填选项序号)。
A.降低温度 B.通人氦气使其压强增大 C.又往容器中充入N2O4 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,不考虑混合后溶液体积的变化,下列说法正确的是
A. 0.1mol·L—1CH3COOH溶液加水稀释后,溶液中c(CH3COO—)/c(CH3COOH)的值减少
B. pH=3的CH3COOH溶液和pH=13的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中 CH3COOH的电离度为1%
C. a mol·L—1H2C2O4溶液与 a mol·L—1的NaOH溶液等体积混合后,c(C2O42—)>c(HC2O4—)>c(H2C2O4)>C(OH—)
D. 0.1 mol·L—1的下列溶液中:①NH4A1(SO4)2溶液②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温、同压下,有同质量的气体X和Y,已知此时Y的体积大于X的体积,则它们的摩尔质量之间的关系是( )
A.M(X)>M(Y)B.M(X)<M(Y)C.M(X)=M(Y)D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件是( )
①X中含碳质量分数 ②X中含氢质量分数 ③X在标准状况下的体积 ④质谱确定X的相对分子质量 ⑤X的质量
A. ①② B. ①②④
C. ①②⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯,无色油状液体,具有苯的气味。化工上主要用于溶剂、分析试剂和有机化合成等。某化学小组欲利用如图所示的装罝通过实验探究:
Ⅰ.苯与液溴发生取代反应;

已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O
Br2↑+MnSO4+Na2SO4+2H2O
(1)仪器X的名称____________________实验室制备溴苯的化学方程式为_____________;这样制取的溴苯可以用 _____________洗涤除Br2。
A.Na2SO3溶液 B.H2O C.乙醇溶液 D.NaOH溶液
(2)制取溴苯的实验操作步骤如下:
①连接装置,其接口顺序为(填字母):d接_________, 接 , 接c
②检查装置的气密性:
③C中加入固体药品,滴加浓硫酸,再打开D处开关K,点燃C处酒精灯;将D装置中的铁丝插入混合液中,一段时间后,D中液体沸腾,原因是 _____________;
④关闭C中分液漏斗的旋塞。
(3)A中对广口瓶进行热水浴的目的__________________。
(4)若B中有淡黄色沉淀生成,能否确定苯与液溴发生了取代反应?________________________(答“能”或“否”)解释其中的原因________________________;
Ⅱ.探究苯与液溴在催化剂作用下的反应机理。
查阅文献:①Br+有强氧化性,可以和水分子发生氧化还原反应②苯与液溴在溴化铁催化下的反应机理共分三步:(填写下列空白)
第一步:Br2+FeBr2![]() Br++FeBr4-
Br++FeBr4-
第二步:Br+ +
请完成第三步反应:____________________________;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧金属可以回收利用,用合金废料(含铁、铜和铝)制取硫酸亚铁和硫酸铜溶液的实验流程如下(部分生成物已略):

(1)合金属于________(填“纯净物”或“混合物”)。
(2)步骤①反应的化学方程式为:2Al+2NaOH+2R=2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为_________。步骤②反应的化学方程式为_____________________________。
(3)由铜制取硫酸铜溶液有以下三种途径:
I.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
II.2Cu+O2![]() 2CuO CuO+H2SO4=CuSO4+H2O
2CuO CuO+H2SO4=CuSO4+H2O
Ⅲ.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
你认为最佳途径是____________(填序号),理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)现有H、C、Na、O、Ca六种元素,请选用其中的元素书写下列化学用语:
①可做食品干燥剂的氧化物__________ ;
②厨房中常用的酸__________________ ;
③侯氏制碱法制得的“碱”____________ ;
④含氧量最高的氧化物______________ 。
(2)铅蓄电池在生产、生活中使用广泛.其构造示意图如图,回答下列问题:
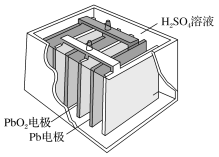
①铅蓄电池充电时是将电能转化为__________ 能。
②铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4===2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断__________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com