
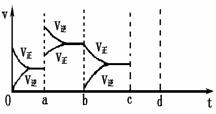
 右图表示在密闭容器中反应:2SO2+O2
右图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;
bc过程中改变的条件可能是 ;
(2)(3分)已知下列两个热化学方程式:
H2(g)+![]() O2(g) = H2O( l ) △H=-285.8 kJ·mol-1
O2(g) = H2O( l ) △H=-285.8 kJ·mol-1
C3H8(g)+5O2(g) = 3CO2(g) +4H2O(l) △H=-2220.2 kJ·mol-1
实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热3847kJ,则混合气体中H2和C3H8的体积比是
(3)、(3分)实验室进行电解氯化钠溶液时,两极共收集到4.48L气体(标况),假设反应后溶液的总体积为200ml,则电解后溶液中氢氧化钠的物质的量浓度
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案科目:高中化学 来源: 题型:
右图表示在密闭容器中C(s)+H2O(g)![]() CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是( )
CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是( )
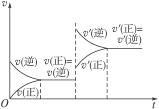
A.增加CO浓度 B.升高温度 C.增大压强 D.增加水蒸气
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东佛山市中大附中高二上期中考试理科化学试卷(带解析) 题型:填空题
(1)对于下列反应:2SO2 + O2 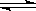 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)右图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,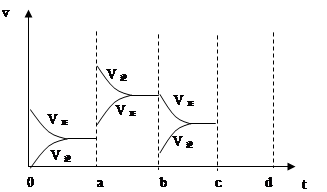
a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸: .
查看答案和解析>>
科目:高中化学 来源:2014届广东佛山市大附高二上期考试理科化学试卷(解析版) 题型:填空题
(1)对于下列反应:2SO2 + O2 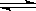 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)右图表示在密闭容器中反应:2SO2+O2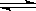 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
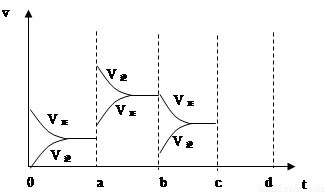
a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸: .
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)㈠在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB![]() zC
zC
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是
;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向
方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是 (填状态);
(4) 若加热后,C的百分含量减小,则正反应是________热反应。
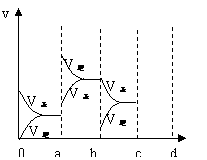 ㈡右图表示在密闭容器中反应:
㈡右图表示在密闭容器中反应:
2SO2+O2![]() 2SO3,△H <0;达到平衡时,
2SO3,△H <0;达到平衡时,
由于条件改变而引起反应速率和化学平衡的变化情况,
⑴a b过程中改变的条件可能是 ;
⑵b c过程中改变的条件可能是 ;
⑶若增大压强时,反应速率变化情况画在c—d处。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com