
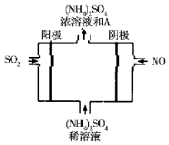
 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
分析 (1)溶液是电中性的,可根据电荷守恒式计算溶液中H+浓度,再计算pH;
(2)根据盖斯定律,由①=③×2+④×2-②得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
(3)①计算各气体的平衡浓度,代入平衡常数表达式计算;
②若T1<T2,可根据温度升高时NO浓度的变化,判断平衡移动的方向,从而判断反应正向进行时是放热还是吸热;
(4)电解时NO转化为(NH4)2SO4的过程发生还原反应,电解池工作时阴极发生还原反应,阳极发生氧化反应,并结合电解质溶液,写出电极反应式,再根据电子守恒写出总反应式,即可判断另一种产物.
解答 解:(1)根据表格提供的离子可知,NH4+水解导致试样溶液呈酸性,根据电荷守恒可知,c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(Cl-)+c(NO3-),c(H+)=10-4mol/L,pH=4,故答案为:4;
(2)由①=③×2+④×2-②得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变△H1=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,故答案为:-746.5;
(3)①平衡时c(NO)=$\frac{0.020mol}{2L}$=0.010mol/L,c(N2)=c(CO2)=$\frac{0.040mol}{2L}$=0.020mol/L,故T1℃时该反应的平衡常数为K1=$\frac{0.020×0.020}{0.01{0}^{2}}$=4,
故答案为:4;
②由于T1<T2,从T1到T2,NO的浓度增大,说明升高温度,平衡逆向移动,由于升高温度平衡向吸热方向移动,所以该反应的逆反应为吸热反应,则△H<0,
故答案为:<;由于T1<T2,从T1到T2,NO的浓度增大,说明升高温度,平衡逆向移动,由于升高温度平衡向吸热方向移动,所以该反应的逆反应为吸热反应,则△H<0;
(4)二氧化硫中硫的元素化合价升高,在阳极发生反应,SO2-2e-+2H2O=SO42-+4H+,一氧化氮中的氮元素化合价降低,在阴极发生反应,一氧化氮得电子生成铵根离子,电极反应为:NO+5e-+6H+=NH4++H2O;根据电子守恒可知总反应为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4,则生成硫酸铵外还有硫酸,
故答案为:硫酸;NO+5e-+6H+=NH4++H2O;5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4.
点评 本题为综合型,涉及考查盖斯定律的应用、平衡常数的计算、影响平衡的因素及电解原理的应用等,重视基础考查,难度中等,易错点为热化学方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 将20mL0.1mol/L氯化锂溶液和20mL0.1mol/LNa2CO3溶液混合后,观察到有白色沉淀生成 | |
| B. | 硼的最高价氧化物对应的水化物是硼酸,硼酸属于弱酸 | |
| C. | Be(OH)2既能溶于强酸,又能溶于强碱溶液 | |
| D. | Be属于金属,Be能与盐酸反应产生氢气,但不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙三醇、乙二醇的水溶液的凝固点很低,乙二醇可作内燃机的抗冻剂,丙三醇用于配制化妆品 | |
| B. | 丙三醇的沸点比乙二醇的沸点高 | |
| C. | 这两种多元醇均易溶于乙醇,难溶于水 | |
| D. | 乙二醇和丙三醇都能与Na发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+、H+、Ba2+ |
| 阴离子 | OH-、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
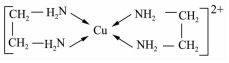
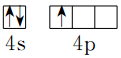 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| C. | 侯氏制碱法工业过程中应用了物质溶解度的差异 | |
| D. | “煤改气”、“煤改电”等工程有利于减少雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
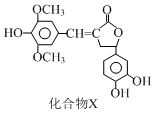
| A. | 每个X分子中含有1个手性碳原子 | |
| B. | 化合物X能使酸性高锰酸钾溶液褪色 | |
| C. | 1 mol化合物X最多能与5 mol NaOH发生反应 | |
| D. | 化合物X与溴水既能发生加成反应又能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
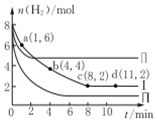 一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )| A. | 该反应在O~8min内的v(CO2)=0.125mol•L-1•min-1 | |
| B. | 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20% | |
| C. | 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆) | |
| D. | 曲线II、曲线III改变条件分别是升高温度、减小压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com