
”¾ĢāÄæ”æŌŚMg£ØNO3£©2ŗĶAl£ØNO3£©3µÄ»ģŗĻČÜŅŗÖŠ£¬NO3©µÄĪļÖŹµÄĮæĪŖ0.7mol£®ĻņøĆČÜŅŗÖŠ¼ÓČė100mL 8molL©1µÄKOHČÜŅŗ£¬Ź¹Ö®³ä·Ö·“Ó¦£¬·“Ó¦Ē°£¬ČōAl3+µÄĪļÖŹµÄĮæÓė»ģŗĻČÜŅŗÖŠĄė×Ó×ÜĪļÖŹµÄĮæµÄ±ČÖµĪŖx£® £Ø²»æ¼ĀĒMg2+ŗĶAl3+µÄĖ®½ā¼°Ė®µÄµēĄėĖłŅżĘšµÄĄė×Ó×ÜŹżµÄ±ä»Æ£©
£Ø1£©xµÄȔֵ·¶Ī§ŹĒ £®
£Ø2£©µ±KOHøÕŗĆĶźČ«ĻūŗÄ£¬ĒŅAl3+Č«²æ×Ŗ»ÆĪŖAlO2©Ź±£¬xµÄȔֵ·¶Ī§ £®
£Ø3£©½«£Ø2£©ÖŠµÄxÖµ¼ĒĪŖx1 £¬ Ōņ£ŗ µ±0£¼x£¼x1Ź±£¬·“Ӧɜ³ÉµÄ³ĮµķĪļµÄ»ÆѧŹ½ĪŖ £®
µ±x£¾x1Ź±·“Ӧɜ³ÉµÄ³ĮµķĪļµÄ»ÆѧŹ½ĪŖ
£Ø4£©Čō·“Ó¦Ē°Al3+µÄĪļÖŹµÄĮæĪŖa mol£¬Ōņa=£ØÓĆŗ¬xµÄ“śŹżŹ½±ķŹ¾£©£®
”¾“š°ø”æ
£Ø1£©0£¼x£¼0.25
£Ø2£©0.1
£Ø3£©Mg£ØOH£©2£»Al£ØOH£©3ŗĶMg£ØOH£©2
£Ø4£©![]()
”¾½āĪö”æ½ā£ŗ£Ø1£©µ±ĶźČ«ĪŖAl£ØNO3£©3Ź±£¬xÓŠ×ī“óÖµ£¬ĻõĖįøłĄė×ÓµÄĪļÖŹµÄĮæĪŖ0.7mol£¬ŌņĀĮĄė×ÓµÄĪļÖŹµÄĮæĪŖ£ŗ0.7mol”Į ![]() =
= ![]() mol£¬Ōņ£ŗx=
mol£¬Ōņ£ŗx= 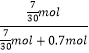 =0.25£¬ÓÉÓŚŹĒĻõĖįĆ¾ŗĶĻõĖįĀĮµÄ»ģŗĻĪļ£¬Ōņx£¼0.25£¬ĖłŅŌxµÄ·¶Ī§ĪŖ£ŗ0£¼x£¼0.25£¬ĖłŅŌ“š°øŹĒ£ŗ0£¼x£¼0.25£»£Ø2£©µ±KOHøÕĶźČ«ĻūŗÄĒŅAl3+Č«²æ×Ŗ»»³ÉAlO2©Ź±£¬“ĖŹ±ČÜŅŗÖŠČÜÖŹĪŖKNO3”¢KAlO2 £¬ øł¾ŻŹŲŗćæÉÖŖ£ŗn£ØK+£©=n£ØNO3©£©+n£ØAlO2©£©£¬¹Źn£ØAlO2©£©=0.1L”Į8mol/L©0.7mol=0.1mol£¬¹Ź£ŗn£ØAl3+£©=0.1mol£¬øł¾ŻµēŗÉŹŲŗćæÉÖŖ£¬n£ØMg2+£©=
=0.25£¬ÓÉÓŚŹĒĻõĖįĆ¾ŗĶĻõĖįĀĮµÄ»ģŗĻĪļ£¬Ōņx£¼0.25£¬ĖłŅŌxµÄ·¶Ī§ĪŖ£ŗ0£¼x£¼0.25£¬ĖłŅŌ“š°øŹĒ£ŗ0£¼x£¼0.25£»£Ø2£©µ±KOHøÕĶźČ«ĻūŗÄĒŅAl3+Č«²æ×Ŗ»»³ÉAlO2©Ź±£¬“ĖŹ±ČÜŅŗÖŠČÜÖŹĪŖKNO3”¢KAlO2 £¬ øł¾ŻŹŲŗćæÉÖŖ£ŗn£ØK+£©=n£ØNO3©£©+n£ØAlO2©£©£¬¹Źn£ØAlO2©£©=0.1L”Į8mol/L©0.7mol=0.1mol£¬¹Ź£ŗn£ØAl3+£©=0.1mol£¬øł¾ŻµēŗÉŹŲŗćæÉÖŖ£¬n£ØMg2+£©= ![]() =
= ![]() =0.2mol£¬Ōņ£ŗx=
=0.2mol£¬Ōņ£ŗx= ![]() =0.1£¬ĖłŅŌ“š°øŹĒ£ŗ0.1£»£Ø3£©µ±0£¼x”Ü0.1Ź±£¬ĒāŃõ»Æ¼Ų¹żĮ棬ĀĮĄė×ÓĶźČ«×Ŗ»Æ³ÉAlO2© £¬ Éś³ÉµÄ³ĮµķĪŖMg£ØOH£©2£»µ±0.1£¼x£¼0.25Ź±£¬ĒāŃõ»Æ¼Ų²»×ć£¬Éś³ÉµÄ³ĮµķĪŖAl£ØOH£©3ŗĶMg£ØOH£©2µÄ»ģŗĻĪļ£¬ĖłŅŌ“š°øŹĒ£ŗMg£ØOH£©2£»Al£ØOH£©3ŗĶMg£ØOH£©2£»£Ø4£©ÉčČÜŅŗÖŠAl3+µÄĪļÖŹµÄĮæĪŖa mol£¬ÓɵēŗÉŹŲŗćæÉÖŖMg2+µÄĪļÖŹµÄĮæĪŖ£ŗ
=0.1£¬ĖłŅŌ“š°øŹĒ£ŗ0.1£»£Ø3£©µ±0£¼x”Ü0.1Ź±£¬ĒāŃõ»Æ¼Ų¹żĮ棬ĀĮĄė×ÓĶźČ«×Ŗ»Æ³ÉAlO2© £¬ Éś³ÉµÄ³ĮµķĪŖMg£ØOH£©2£»µ±0.1£¼x£¼0.25Ź±£¬ĒāŃõ»Æ¼Ų²»×ć£¬Éś³ÉµÄ³ĮµķĪŖAl£ØOH£©3ŗĶMg£ØOH£©2µÄ»ģŗĻĪļ£¬ĖłŅŌ“š°øŹĒ£ŗMg£ØOH£©2£»Al£ØOH£©3ŗĶMg£ØOH£©2£»£Ø4£©ÉčČÜŅŗÖŠAl3+µÄĪļÖŹµÄĮæĪŖa mol£¬ÓɵēŗÉŹŲŗćæÉÖŖMg2+µÄĪļÖŹµÄĮæĪŖ£ŗ ![]() £¬ČÜŅŗÖŠĄė×Ó×ܵÄĪļÖŹµÄĮæĪŖČżÖÖĄė×ÓÖ®ŗĶ£¬Ņ²µČÓŚ
£¬ČÜŅŗÖŠĄė×Ó×ܵÄĪļÖŹµÄĮæĪŖČżÖÖĄė×ÓÖ®ŗĶ£¬Ņ²µČÓŚ ![]() mol£¬¹Ź£ŗ
mol£¬¹Ź£ŗ ![]() +amol+0.7mol=
+amol+0.7mol= ![]() mol£¬
mol£¬
½āµĆ£ŗa= ![]() £¬ĖłŅŌ“š°øŹĒ£ŗ
£¬ĖłŅŌ“š°øŹĒ£ŗ ![]() £®
£®


 Ņ»ĻßĆūŹ¦ĢįÓÅŹŌ¾ķĻµĮŠ“š°ø
Ņ»ĻßĆūŹ¦ĢįÓÅŹŌ¾ķĻµĮŠ“š°ø Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼±ķŹ¾Ä³¹ĢĢ¬µ„ÖŹA¼°Ęä»ÆŗĻĪļÖ®¼äµÄ×Ŗ»Æ¹ŲĻµ£ØijŠ©²śĪļŗĶ·“Ó¦Ģõ¼žŅŃĀŌČ„£©£®»ÆŗĻĪļBŌŚ³£ĪĀ³£Ń¹ĻĀĪŖĘųĢ壬BŗĶCµÄĻą¶Ō·Ö×ÓÖŹĮæÖ®±ČĪŖ4£ŗ5£¬»ÆŗĻĪļDŹĒÖŲŅŖµÄ¹¤ŅµŌĮĻ£® 
£Ø1£©Š“³öAŌŚ¼ÓČČĢõ¼žĻĀÓėH2·“Ó¦µÄ»Æѧ·½³ĢŹ½
£Ø2£©Š“³öEÓėAµÄĒā»ÆĪļ·“Ӧɜ³ÉAµÄ»Æѧ·½³ĢŹ½
£Ø3£©Š“³öŅ»øöÓÉDÉś³ÉBµÄ»Æѧ·½³ĢŹ½£»
£Ø4£©½«5mL0.10molL©1µÄEČÜŅŗÓė10mL0.10molL©1µÄNaOHČÜŅŗ»ģŗĻ£® ¢ŁŠ“³ö·“Ó¦µÄĄė×Ó·½³ĢŹ½£»
¢Ś·“Ó¦ŗóČÜŅŗµÄpH7£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£¬ĄķÓÉŹĒ£»
¢Ū¼ÓČČ·“Ó¦ŗóµÄČÜŅŗ£¬ĘäpH£ØĢī”°Ōö“ó”±”¢”°²»±ä”±»ņ”°¼õŠ””±£©£¬ĄķÓÉŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æH”¢C”¢N”¢C”¢Na”¢S”¢FeŹĒ֊ѧ»Æѧ֊³£¼ūµÄŌŖĖŲ£¬Ēėøł¾ŻĢāŅā»Ų“šÓėÕāŠ©ŌŖĖŲÓŠ¹ŲµÄĪŹĢā:
£Ø1£©FeŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆ:___________________£»
£Ø2£© Š“³ö(CN)2µÄµē×ÓŹ½: __________________£»
£Ø3£©ÓƵē×ÓŹ½±ķŹ¾Na3N µÄŠĪ³É¹ż³Ģ: __________________£»
£Ø4£©ø÷ÖÖµŖŃõ»ÆĪļ(NO”¢NO2)ŹĒÖ÷ŅŖµÄ“óĘųĪŪČ¾ĪļÖ®Ņ»£¬ÖĪĄķ°±Ńõ»ÆĪļ(NOx)·ĻĘųµÄ·½·ØÖ®Ņ»ŹĒÓĆNaOHČÜŅŗ½ųŠŠĪüŹÕ£¬Ęä·“Ó¦ŌĄķæɱķŹ¾ČēĻĀ:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
ĻÖÓŠNO ÓėNO2µÄ»ģŗĻĘųĢ壬½«ĘäĶØČė50 mL 2 mol/LµÄNaOH ČÜŅŗÖŠ£¬Ē”ŗĆĶźČ«ĪüŹÕ£¬²āµĆČÜŅŗÖŠŗ¬ÓŠNO3-0.02 mol£¬»ģŗĻĘųĢåÖŠv(NO): v(NO2)=_________£»
£Ø5£© ĻņFeI2ČÜŅŗÖŠ²»¶ĻĶØČėCl2£¬ČÜŅŗÖŠI-”¢I2”¢IO3-”¢Fe3+”¢Fe2+µČĮ£×ÓĪļÖŹµÄĮæĖęn(Cl2)/n(FeI2 )µÄ±ä»ÆæÉÓĆĻĀĶ¼¼ņµ„±ķŹ¾
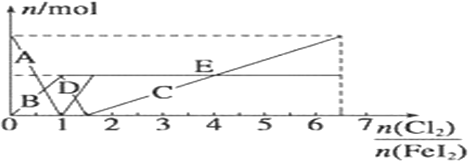
µ±n(Cl2)/n(FeI2 )=6.5 Ź±£¬ČÜŅŗÖŠn(Cl-)£ŗn(IO3-)=_________£»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ė®ÖŠŗ¬Įæ×ī¶ąµÄĀČ»ÆĪļŹĒ
A.NaClB.MgCl2C.KClD.CaCl2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĖłŃ§ÖŖŹ¶£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŖĖŲÖÜĘŚ±ķ1”«20ŗÅŌŖĖŲÖŠ£¬½šŹōŠŌ×īĒæµÄŌŖĖŲŹĒ__________(ĢīŌŖĖŲ·ūŗÅ£¬ĻĀĶ¬)£»ŹōÓŚĻ”ÓŠĘųĢåµÄŹĒ________________£»·Ē½šŹōŠŌ×īĒæµÄŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ_______________________”£
£Ø2£©ŅŃÖŖNO2ŗĶN2O4Ö®¼ä·¢ÉśæÉÄę·“Ó¦£ŗ2NO2 (g) (ŗģ×ŲÉ«) ![]() N2O4(g) (ĪŽÉ«)”£½«×°ÓŠNO2 ŗĶN2O4»ģŗĻĘųĢåµÄÉÕĘ潞ČėČČĖ®ÖŠ£¬¹Ū²ģµ½µÄĻÖĻóŹĒ____________________£¬²śÉśøĆĻÖĻóµÄŌŅņŹĒ____________________________________”£
N2O4(g) (ĪŽÉ«)”£½«×°ÓŠNO2 ŗĶN2O4»ģŗĻĘųĢåµÄÉÕĘ潞ČėČČĖ®ÖŠ£¬¹Ū²ģµ½µÄĻÖĻóŹĒ____________________£¬²śÉśøĆĻÖĻóµÄŌŅņŹĒ____________________________________”£
£Ø3£©Ņ»¶ØĢõ¼žĻĀ£¬Ļņ2LŗćČŻĆܱÕČŻĘ÷ÖŠ°“Ģå»ż±Č1:3³äČė4.48L£Ø±ź×¼×“æö£©N2ŗĶH2µÄ»ģŗĻĘųĢ壬·¢Éś·“Ó¦N2£Øg£©+3H2£Øg£©![]() 2NH3£Øg£©,3minŹ±·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬²āµĆc(N2)=0.02mol”¤L£1”£
2NH3£Øg£©,3minŹ±·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬²āµĆc(N2)=0.02mol”¤L£1”£
¢Ł 0”«3minÄŚ£¬v (NH3)=___________________”£
¢ŚĻĀĮŠŠšŹöæÉÖ¤Ć÷ÉĻŹö·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ_________£ØĢīŠņŗÅ£©”£
a. v(H2)= 3 v(N2) b.ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
c.ĆæĻūŗÄ1mol N2£¬Ķ¬Ź±Éś³É2mol NH3
d. N2”¢H2ŗĶNH3µÄĪļÖŹµÄĮæÅØ¶Č²»ŌŁ±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŅŗĢ¬ÓŠ»śĪļÖŠ£¬ĆܶȱČĖ®“óµÄŹĒ( )
A.ĖÄĀČ»ÆĢ¼
B.±½
C.ŅŅ“¼
D.Ö²ĪļÓĶ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆÓŅĶ¼ĖłŹ¾×°ÖĆæÉŅŌ½«ĪĀŹŅĘųĢåCO2×Ŗ»ÆĪŖČ¼ĮĻĘųĢåCO”£ĻĀĮŠĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ
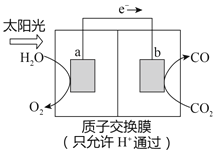
A. µē¼«b±ķĆę·¢Éś»¹Ō·“Ó¦
B. øĆ×°ÖĆ¹¤×÷Ź±£¬H+“Óa¼«ĒųĻņb¼«ĒųŅʶÆ
C. øĆ×°ÖĆÖŠĆæÉś³É1molCO£¬Ķ¬Ź±Éś³É0.5molO2
D. øĆ¹ż³ĢŹĒ½«»ÆѧÄÜ×Ŗ»ÆĪŖµēÄܵĹż³Ģ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪüŹÕ¶ąÓąµÄĀČĘų£¬×īŗĆŃ”ÓĆ
A.³ĪĒåŹÆ»ŅĖ®B.±„ŗĶŹ³ŃĪĖ®C.ÅØNaOHČÜŅŗD.ÅØĮņĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĘäČÜŅŗÖŠæÉÄÜŗ¬ÓŠSO42£”¢CO32££¬ĪŖ¼ģŃéŹĒ·ńŗ¬ÓŠSO42££¬³żŠčÓĆBaCl2ČÜŅŗĶā£¬»¹ŠčÓƵ½µÄČÜŅŗŹĒ
A.Ļ”ĮņĖįB.Ļ”ŃĪĖįC.NaOHČÜŅŗD.NaNO3ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com