
| A、用铁粉代替铁片 |
| B、增大压强 |
| C、提高反应的温度 |
| D、增大盐酸的浓度 |


科目:高中化学 来源: 题型:
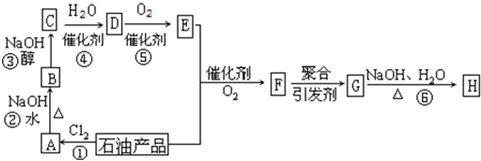
 A、C、D、E、F五种有机物可发生如图所示的转化.已知:C的结构简式为
A、C、D、E、F五种有机物可发生如图所示的转化.已知:C的结构简式为 ,D能跟NaHCO3发生反应,D和E的相对分子质量相等,F为无支链的化合物.
,D能跟NaHCO3发生反应,D和E的相对分子质量相等,F为无支链的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2px2表示2px能级有两个轨道 |
| B、在CS2分子中α键与π键的数目之比是2:1 |
| C、电子仅在激发态跃进到基态时才会产生原子光谱 |
| D、表示一个某原子在第三电子层上有10个电子可以写3s23p63d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
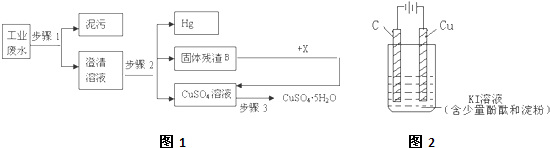
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、③⑥ |
| C、②④⑤ | D、②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com