
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子构成计算;
(2)根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{N}$结合分子构成计算;
(3)根据n=$\frac{m}{M}$计算;
(4)根据n=cV=$\frac{m}{M}$计算.
解答 解:(1)质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为$\frac{14}{28}$:$\frac{15}{30}$=1:1,氮原子和氧原子的个数比为(2×1+1):1=3:1,
故答案为:1:1; 3:1;
(2)V=5mol×22.4L/mol=112L,所含氧原子的数目约为5mol×2×6.02×1023=6.02×1024,
故答案为:112L;6.02×1024;
(3)n(Na2X)=$\frac{1}{2}$n(Na+)=0.2mol,M(Na2X)=$\frac{12.4g}{0.2mol}$=62g/mol,M(X)=62-46=16,则X为O元素,化学式为Na2O,
故答案为:62g/mol;Na2O;
(5)n(NaOH)=$\frac{1g}{40g/mol}$=0.025mol,V=$\frac{0.025mol}{0.2mol/L}$=0.125L=125mL,
n(CuSO4•5H2O)=n(CuSO4)=0.05L×0.2mol/L=0.01mol,m(CuSO4•5H2O)=0.01mol×250g/mol=2.5g,
故答案为:125; 2.5.
点评 本题考查物质的量的有关计算,题目难度较大,比较综合,注意物质的量与质量、体积、粒子数目、浓度的计算公式的运用.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 电池工作时,MnO2失去电子 | |
| B. | 电池工作时,电子由锌经外电路流向MnO2 | |
| C. | 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 | |
| D. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H2 3.36L | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
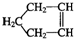 可简写为
可简写为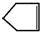 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: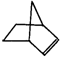
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:5 | B. | 3:5:3 | C. | 5:3:3 | D. | 8:7:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
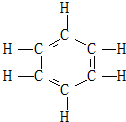 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )| A. | ①④ | B. | ④ | C. | ②③ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com