
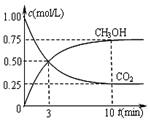
 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
分析 (1)①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
结合盖斯定律计算,①-②-2×③得到碳与水蒸气反应的热化学方程式;
(2)①可逆反应中增大一种反应物浓度可以提高另一种反应物转化率;
依据CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0为气体体积减小的、放热反应特点结合影响化学平衡移动的因素解答;
②计算平衡时氢气、水的浓度,再根据K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$计算平衡常数;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
②反应速率V=$\frac{△c}{△t}$计算得到氢气反应速率,速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量得到平衡浓度,计算此时平衡常数,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),计算此时浓度商和平衡常数比较判断反应进行方向.
解答 解:(1)①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
结合盖斯定律计算,①-②-2×③得到碳与水蒸气反应的热化学方程式为:C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3,
故答案为:△H1-△H2-2△H3;
(2)①C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0生成二氧化碳和氢气的物质的量之比为1:2,而CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,二氧化碳和氢气物质的量之比为1:3,相对与增大二氧化碳浓度,所以氢气的转化率大于二氧化碳转化率;
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0为气体体积减小的、放热反应,要想提高甲醇的产率可以采取的措施是降低温度、增大压强使平衡向正向移动;
故答案为:后者大;降低温度、增大压强;
②平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.50 0.75 0.75 0.75
则平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{2}}$=$\frac{16}{3}$=5.33,
故答案为:5.33;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
故答案为:<;<;
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.5 1.5 0.5 0.5
30min量(mol/L) 0.5 1.5 0.5 0.5
对反应I,前10min内的平均反应速率v(CH3OH)=$\frac{1}{3}$V(H2)=$\frac{1}{3}$×(6-4.5)mol2L10min=0.025mol•L-1•min-1;
平衡常数K=$\frac{0.5×0.5}{0.5×1.{5}^{3}}$=$\frac{0.5}{1.{5}^{3}}$,
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
3 0min量(mol/L) 0.5 1.5 0.5 0.5
(mol/L) 1 1.5 0.5 1
浓度商Q=$\frac{1×0.5}{1×1.{5}^{3}}$=$\frac{0.5}{1.{5}^{3}}$=K,
所以平衡不移动;
故答案为:0.025mol•L-1•min-1 ;不.
点评 本题为综合题,涉及反应热的计算、化学平衡平衡移动影响因素、化学平衡常数计算,题目难度中等,解题关键需掌握化学平衡理论,注意三段式的应用.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 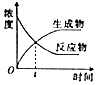 图表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态 | |
| B. | 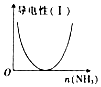 图表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. |  图表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂 | |
| D. | 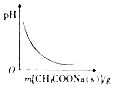 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
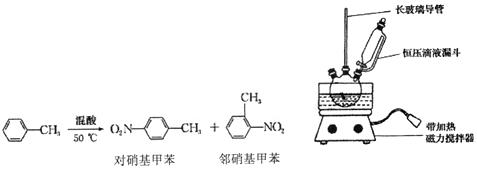
| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 0.1mol/L NaClO溶液/mL | 0.1mol/L NaCl溶液/mL | 0.2mol/L NaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | 4.0 | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com