
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
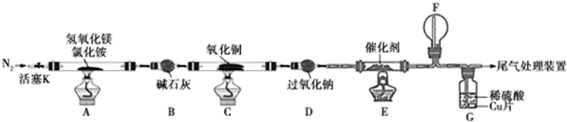
分析 A中反应得到MgOHCl,还生成NH3与H2O,碱石灰干燥氨气,C中氨气与氧化铜反应会得到氮气与水,D最过氧化钠水反应生成氧气,D中氨气与氧气发生催化氧化,F中NO与氧气反应得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸与Cu反应.
(1)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O;
(2)G中二氧化氮、氨气溶解会导致倒吸可能,通入氮气好可以防止倒吸;
(3)F中NO与氧气反应生成二氧化氮;
(4)Cu与稀硝酸反应生成硝酸铜,溶液变蓝色;
(5)红色物质为Cu或Cu2O或二者混合物,固体质量减少质量为减少的氧元素质量,再计算CuO中氧元素质量,可以判断红色固体的组成,根据Cu元素守恒、红色固体总质量计算组成物质的量,进而计算转移电子;
(6)Cu能与浓硫酸反应,应用稀H2SO4溶液溶解,溶液中出现蓝色,说明红色固体中含有Cu2O.
解答 解:A中反应得到MgOHCl,还生成NH3与H2O,碱石灰干燥氨气,C中氨气与氧化铜反应会得到氮气与水,D最过氧化钠水反应生成氧气,D中氨气与氧气发生催化氧化,F中NO与氧气反应得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸与Cu反应.
(1)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O,反应方程式为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O,
故答案为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O;
(2)G中二氧化氮、氨气溶解会导致倒吸可能,通入氮气好可以防止倒吸,
故答案为:防止倒吸;
(3)F中NO与氧气反应生成红棕色的二氧化氮气体,
故答案为:生成红棕色气体;
(4)Cu与稀硝酸反应生成硝酸铜,溶液变蓝色,反应离子方程式为:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O,
故答案为:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O;
(5)红色物质为Cu或Cu2O或二者混合物,固体质量减少质量为减少的氧元素质量,则减少的氧元素质量为8g-6.8g=1.2g,而CuO中氧元素质量为8.0g×$\frac{16}{80}$=1.6g>1.2g,故红色固体为Cu、Cu2O混合物,设二者物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+2y=\frac{8}{80}}\\{64x+144y=6.8}\end{array}\right.$,解得x=0.05,y=0.025,则转移电子为0.05mol×2+0.025mol×2=0.15mol,
故答案为:Cu和Cu2O;0.15;
(6)Cu能与浓硫酸反应,Cu2O能与稀酸反应得到Cu2+,用稀H2SO4溶液溶解,溶液中出现蓝色,说明红色固体中含有Cu2O,
故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
点评 本题考查物质的制备及性质探究实验,关键是理解各装置作用,熟练掌握元素化合物性质,(5)中注意利用氧元素质量变化判断固体组成,也可以利用Cu元素质量确定,(6)中充分利用题目信息进行实验设计,难度中等.


科目:高中化学 来源: 题型:选择题
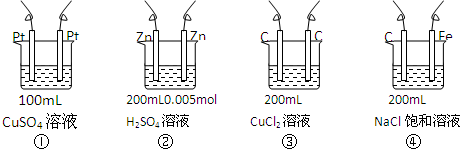
| A. | ①<②<③<④ | B. | ①<③<②<④ | C. | ②<①<④<③ | D. | ①<②<④<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水且显酸性 | |
| B. | 点燃是H2和Cl2化合的惟一条件 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | 液氯和氯水不是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1451.6 kJ/mol | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
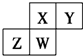
| A. | X与Y形成原子个数比1:1的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | W的最高正价与最低负价的绝对值可能相等 | |
| C. | 气态氢化物的稳定性:Z>W>X>Y | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X元素在周期表中的位置只能是第二周期第ⅣA族 | |
| B. | 若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强 | |
| C. | 若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少 | |
| D. | 若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X、Y一定在同一周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com