
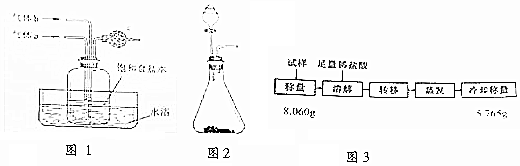
分析 (1)根据气体的溶解性分析;氨气为碱性气体,用酸吸收;
(2)根据反应物物质状态和发生条件分析;
(3)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(4)水浴加热能使加热平稳,便于控制温度;温度过高,碳酸氢钠溶解度大,不利于产品的析出;
(5)反应结束后,将热水浴换成冰水浴,冷却15min左右再进行过滤,目的是减小碳酸氢钠的溶解度,提高产率;
(6)设样品中NaHCO3、NaCl的质量分别为x、y,则x+y=8.060,加盐酸,NaHCO3受热分解得到氯化钠,最终的晶体为碳酸氢钠分解产生的氯化钠和原样品中的氯化钠总质量为5.765g,据此计算;最终测定结果的相对误差为1.5%,说明比实际误差偏大,则可能为产物水分未完全蒸干.
解答 解:(1)氨气极易溶于水,二氧化碳溶于水,溶解度相对较小,为有利于二氧化碳的溶解,则通二氧化碳的导气管伸入液面之下,且先通入氨气,形成碱性溶液,吸收二氧化碳;氨气不能排放空气中,用稀硫酸吸收;
故答案为:氨气;二氧化碳;先通a再通b;稀硫酸;
(2)图2装置为固液不加热型,制备氨气时,可选用向浓氨水中加生石灰的方式制取;制备二氧化碳时,可选用向大理石中加稀盐酸的方式制取,发生的离子方程式为:CaCO3+2H+→Ca2++CO2↑+H2O,
故答案为:浓氨水;CaCO3+2H+→Ca2++CO2↑+H2O;
(3)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,化学方程式为:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl;
(4)水浴加热有利于加热平稳,便于控制温度;水浴温度维持在42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高,产物的溶解度大,不利于晶体析出;
故答案为:加热平稳,便于控制温度;产物溶解度高;
(5)碳酸氢钠的溶解度随温度的降低而降低,反应结束后,将热水浴换成冰水浴,冷却15min左右再进行过滤,目的是增加碳酸氢钠的析出率,提高产率;
故答案为:增加碳酸氢钠的析出率,提高产率;
(6)设样品中NaHCO3、NaCl的质量分别为x、y,则x+y=8.060,加盐酸,NaHCO3受热分解得到氯化钠,根据反应NaHCO3+HCl→NaCl+CO2↑+H2O,通过反应得到的氯化钠质量为:$\frac{58.5x}{84}$,最终的晶体为碳酸氢钠分解产生的氯化钠和原样品中的氯化钠总质量为5.765g,则$\frac{58.5x}{84}+y$=5.765,联合两式解得x=7.56g,该试样中NaHCO3的质量分数为$\frac{7.56}{8.060}×100%$=0.94;最终测定结果的相对误差为1.5%,说明比实际误差偏大,则可能为产物水分未完全蒸干;
故答案为:0.94;产物水分未完全蒸干等.
点评 本题乙氨碱法为载体,考查了物质分析判断,碳酸氢钠、氨气、二氧化碳的性质,气体制备与装置选择,计算等知识点,掌握工艺流程和反应原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙醇中分子数为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 1.8g的NH4+中含有的电子数为1.1NA | |
| D. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有氢离子 | B. | c(H+)=1.0×107mol/L | ||
| C. | c(H+)>c(OH-) | D. | c(H+)越大,酸性越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com