
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将 6.00 g 甲加热至完全分解,只得到一种常见金属单质和 6.72 L 的 H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀既可以溶于盐酸,也可溶于 NaOH 溶液。化合物乙在催化剂存在下可分解得到H2 和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲是_______________;乙是______________。( 填化学式)
(2)甲与水反应的化学方程式是____________。
(3)气体丙的分子式是____________。
(4)乙在加热条件下可与 CuO 发生反应,生成红色固体和气体丙,写出该反应的化学方程式________________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证:__________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O;Cu、Cu2O 均可以溶解在 HNO3 溶液中)
(6)甲与乙之间_____________ (填“可能”或“不可能”)发生反应产生H2,判断理由是_______________。
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:2016-2017学年河南省高一12月月考化学卷(解析版) 题型:选择题
取两份铝粉,一份投入足量浓氢氧化钠溶液中,一份投入足量盐酸中,充分反应,产生等量氢气。则两份铝粉的质量之比为( )
A.1: 2 B.1: 3 C.3 : 2 D.1 : 1
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.用重结晶法可以提纯苯甲酸(含砂子)、硝酸钾(含氯化钠)括号内为杂质
B.从海带中提取碘,需经过以下实验步骤:灼烧、溶解、过滤、萃取分液、蒸馏
C.加热法不可以分离I2和NH4Cl固体混合物
D.用酸性KMnO4溶液可以检验绿矾(FeSO4·7H2O)是否变质
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.碱性溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是 ( )
A.观察加热时是否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,滴加澄清石灰水,观察有无白色沉淀产生
D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:填空题
(1)向某 NaOH 溶液中投入一块 Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为_________________________。
(2)实验室常用还原性 Fe 粉与水蒸气反应的实验来研究 Fe 的还原性,则该反应的化学反应方程式为_________________________。
(3)Fe(OH)2 制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为________________________。
(4)实验时制备 Al(OH)3 时,常用可溶性铝盐(如 Al2(SO)4)与氨水反应进行制备。某课外小组在实验时不慎向 Al2(SO)4 溶液中加入了过量 NaOH 溶液,最终并没有制出白色沉淀 Al(OH)3,则该小组同学实验时发生的总离子反应方程式为______________________。
(5)充分煅烧 CoC2O4 后可得到 2.41g 钴的氧化物和 1.344L(标准状况)CO2 气体,则生成钴的氧化物的化学式为________________,煅烧 CoC2O4 的化学反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.最终出现灰绿色沉淀 D.无变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
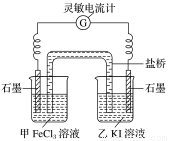
(2)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:填空题
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含 有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgC l2·6H2O
l2·6H2O MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com