
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀
有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
(1)ClO2中所有原子_____________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用_________
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是( )
A.二氧化氯可广泛用于工业和饮用水处理
B.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
C.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为_____________________________。缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ___________________,此法相比欧洲方法的优点是____________________________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸
钠,化学反应方程式为______________________________________________________。
此法提高了生产及储存、运输的安全性,原因是 _________________________________。
(1)不是 C (每空1分) (2) A、B、C (3分,每选一个1分)
(3)2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O (2分)
(4)2NaClO2+Cl2=2NaCl+2ClO2 (2分)安全性好,没有产生毒副产品 (2分)
(5)H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O (2分)
反应过程中生成的二氧化碳起到稀释作用 (2分)
解析试题分析:(1)氯最外层7个电子,氧最外层6个电子,氯失去四个电子无法形成8电子结构,故ClO2中所有原子是不是都满足8电子结构;杂质气体呈碱性,故可用浓硫酸除去。(2)A、B、C均正确。(3)氯酸钠氧化浓盐酸的方程式为:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O(4)氯气与固体亚氯酸钠反应的方程式为:2NaClO2+Cl2=2NaCl+2ClO2该方法与欧洲的相比较没有杂质气体Cl2生成,故安全性好 (5)硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠的方程式为:H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O;此法提高了生产及储存、运输的安全性,原因是反应过程中生成的二氧化碳起到稀释作用
考点:考查化学与技术


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为 ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为 (用离子符号表示),其中形成的化合物中能发生潮解的是 (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式: 。
②Be(OH)+与强碱溶液反应的离子方程式: 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是 (选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳

 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐

 精盐
精盐

 滤液
滤液
 食盐晶体
食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: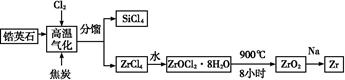
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种比氯气更好的净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下,回答下列问题: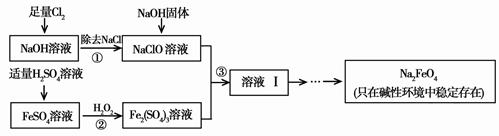
(1)氯气作净水消毒剂是因为它溶于水生成了________,它有强的氧化性,能杀菌消毒。
(2)步骤②反应的离子方程式是 。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线II比曲线I对应的污水pH________(填“高”或“低”)。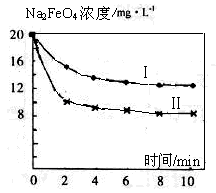
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_____倍
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用白云石制备高纯氧化镁的工艺流程如下:
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
(1)为了提高白云石的煅烧效果,可以采取的措施是 。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 。
| A.蒸发皿 | B.坩埚 | C.泥三角 | D.石棉网 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是: 、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: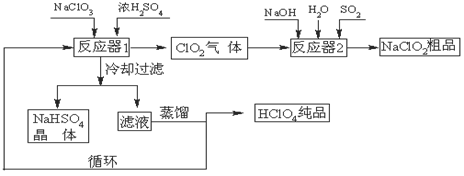
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的
作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、A12O3、SiO2等)制备铬黄的工艺流程如下:
(1)将铬污泥粉碎的目的是 ,操作a的名称为 ;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
(3)写出加入30%H2O2过程中发生的离子反应方程式: ;
(4)实验室洗涤铬黄沉淀的方法: ;
(5)写出浓盐酸与A12O3反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有A、B、C、D四个中等城市,它们水源、能源充足,交通便利。它们相对地理位置如下图所示。各城市各有其特点:A城是风光秀丽,人口稠密,土地供应紧张的旅游城市,环保要求高,近郊有丰富的FeS2资源;B城是一个新兴的工业城市,已建有大型磷肥厂,土地供应充足。C城近郊有丰富的磷灰石资源,工业发达,但使用H2SO4的工业不多,土地供应充足;D城是一个古老的城市,它的周围是重要的农业区,是大量肥料的集散地。现拟建年产1×105 t硫酸的工厂,厂址应选在 ( )。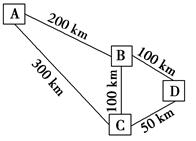
A.A城近郊 B.B城近郊 C.C城近郊 D.D城近郊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com