
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
【答案】D
【解析】A、50min时,反应达到平衡,甲烷的转化率(0.5-0.15)/0.5×100%=70.0%,故A正确;B、如果该反应是吸热反应,T2时达到平衡,CH4的物质的量大于T1,升高温度平衡向正反应方向进行,消耗甲烷较多,因此T1>T2,故B错误;C、
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度:0.5 1.2 0 0 0
变化: 0.4 0.8 0.4 0.4 0.8
平衡: 0.1 0.4 0.4 0.4 0.8 根据化学平衡常数的表达式,K=c2(H2O)×c(CO2)×c(N2)/(H2O)×c(CO2)×c(N2)/[c2(NO2)×c(CH4)]=0.82×0.4×0.4/(0.42×0.1)=6.4,再充入0.3molCH4和0.8molH2O,此时的Qc=1.62×0.4×0.4/(0.42×0.4)=6.4=K,化学平衡不移动,故C错误;D、达到平衡后,再充入0.5molCH4和1.2molNO2,平衡向正反应方向移动,N2的浓度增大,但氮气的体积分数减小,故D正确。


科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析不正确的是

A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e—+OH-==NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键说法正确的是( )
A.构成单质分子的微粒中不一定含有化学键
B.只含有共价键的物质一定是共价化合物
C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D.CaCl2 中既有共价键又有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面.”这里的“石碱”是指
A. KOH B. KAl(SO4)2 C. KHCO3 D. K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1
B. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
C. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
D. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备BaCl2的工艺流程图如图:
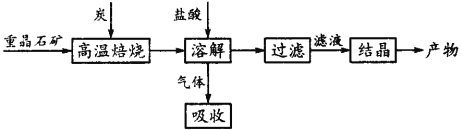
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)![]() 4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
BaSO4(s)+2C(s)![]() 2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() ________________。
________________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) ![]() 2CO(g)的ΔH=____________kJ·mol-1。
2CO(g)的ΔH=____________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com