
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: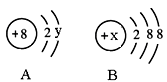
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
(1)2,2,3,3(每空均为1分)
(2)①6(1分);②Ar(1分,写名称不得分),14≤x≤17
(3)+6/x; 1或2(答对一个得1分) (4)4mol/L(无单位扣1分)
解析试题分析:(1)乙烯和环丁烷(C4H8)的最简式都是CH2,所以28g乙烯和环丁烷(C4H8)的混合气体中碳原子的物质的量=28g÷14g/mol=2mol。因此若NA表示阿伏加德罗常数,则28g乙烯和环丁烷(C4H8)的混合气体中含有2NA个碳原子;分子总数为NA个的NO2和CO2混合气体的物质的量是1mol,由于NO2和CO2均是含有2个氧原子的,所以分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以1mol37Cl中,中子数比质子数多(37-17-17)×NA=3 NA个;1L 1mol/LFe2(SO4)3溶液中溶质硫酸铁的物质的量=1L×1mol/L=1mol,在溶液中硫酸铁的电离方程式为Fe2(SO4)3=2Fe3++3SO42-,所以溶液中含3NA个SO42-离子。
(2)①若A表示某元素的原子,则核外电子数=质子数,即2+y=8,所以y=6。
②若B表示某稀有气体元素的原子,则该元素的质子数=2+8+8=18,因此则该元素是Ar,其的单质的化学式为Ar。若B是阴离子的结构示意图,则B是第三周期的非金属,因此x的取值范围是14≤x≤17。
(3)氧元素的化合价是-2价,则 RxO42-中R的化合价为+(8-2)÷x=+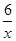 (用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+
(用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+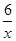 降低到+4价,则0.3mol×(
降低到+4价,则0.3mol×(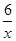 -4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+
-4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+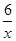 升高到+4价,则0.3mol×(4-
升高到+4价,则0.3mol×(4-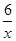 )×x=0.6mol,解得x=2。
)×x=0.6mol,解得x=2。
(4) 将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则根据原子守恒可知,硫酸盐中SO42-的质量=46.2g-7.8g=38.4g,物质的量=38.4g÷96g/mol=0.4mol,因此原硫酸的物质的量也是0.4mol,其浓度=0.4mol÷0.1L=4.0mol/L。
考点:考查物质的量、物质的量浓度以及化合价的有关计算;微粒结构示意图的应用与判断


科目:高中化学 来源: 题型:填空题
现用98%的浓H2SO4(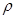 =1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)请将下列操作按正确的序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加水至刻度 |
| D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列小题.
(1)0.5 mol H2O的质量为 g,共有____________个分子,___________个电子。
(2) 0.01mol某物质的质量为1.08g,则此物质的摩尔质量为__________________。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4_____________g;需要CuSO4·5H2O _____g。
(4)如图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
①该浓硫酸的物质的量浓度_____________,
②用该浓硫酸配制200mL1mol/L的稀硫酸,量筒所需量取该浓硫酸的体积是_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)同温同压下,同体积的NH3和H2S气体的质量比是___________;同质量的NH3和H2S气体的体积比是__________;同质量的NH3和H2S气体中所含氢原子个数比是___________;若两者所含氢原子个数相等,它们的物质的量比是________。
(2)Na2SO4??10H2O的摩尔质量是__________,483gNa2SO4??10H2O中所含Na2SO4??10H2O的物质的量是_______,所含Na+的物质的量是_________,所含H2O分子的数目是_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一块锌片插入足量CuSO4溶液1L中,可以观察到锌片表面有黄色附着物析出,最后称量时锌片质量减轻了0.1g(假设溶溶液体变化忽略不计),求:
(1)(1)参加反应的还原剂的物质的量是 ;
(2)还原产物的物质的量是 ;
(3)生成ZnSO4的物质的量浓度是 ;
(4)溶液的质量 ;(填“增加”或“减少”)
(5)写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式: 。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com