
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
分析 A.酸性溶液加石蕊变红色;
B.先加盐酸排除碳酸根离子、银离子等干扰,后加氯化钡生成沉淀为硫酸钡;
C.碱性溶液遇酚酞变红;
D.气体为二氧化碳,原溶液可能为碳酸氢盐或可溶性碳酸盐.
解答 解:A.酸性溶液加石蕊变红色,原溶液为酸或盐溶液,如盐酸、硫酸氢钠均符合,故A错误;
B.先加盐酸排除碳酸根离子、银离子等干扰,后加氯化钡生成沉淀为硫酸钡,则原溶液中含SO42-,故B正确;
C.碱性溶液遇酚酞变红,则原溶液为碱或盐溶液,如NaOH、碳酸钠均符合,故C错误;
D.气体为二氧化碳,原溶液可能为碳酸氢盐或可溶性碳酸盐,则原溶液中有CO32-或HCO3-,或二者均存在,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握常见离子的检验方法、试剂和现象为解答的关键,侧重分析与应用能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
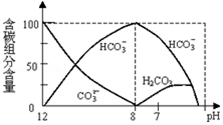 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: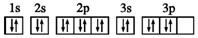 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

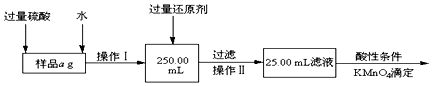
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2S | C. | (NH4)2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com