
NH3·H2O在水溶液中的电离方程式为_____________________________________________,
其电离常数表达式为_____________________________________________________________。
只改变下列一种条件:
①升高温度 ②加水稀释 ③加少量NaOH(s) ④通少量HCl(g) ⑤加入NH4Cl(s) ⑥加入Na2CO3(s)
其中能实现下列要求的是:
(1)使电离平衡正向移动的有________。
(2)使c(NH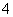 )减小的有________。
)减小的有________。
(3)使c(H+)增大的有________。
(4)使平衡常数Kb增大的有________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
咖啡酸是一种在医学上具有较广泛的应用的医药中间体和原料药。
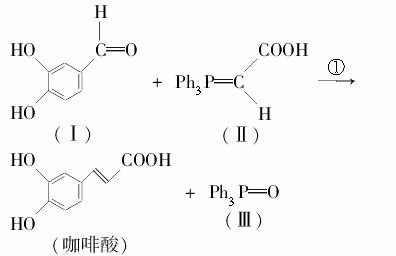
咖啡酸苯乙酯是一种天然抗癌药物,由苯乙烯合成咖啡酸苯乙酯的过程之一是:

(1)化合物Ⅰ的分子式为________;反应③的反应类型为________反应。
(2)若化合物Ⅱ和Ⅲ中的“Ph”为苯基、“P”为磷原子,则化合物Ⅱ的结构简式为________________;咖啡酸苯乙酯的键线式结构简式为________________。
(3)足量的溴水与咖啡酸发生反应的化学方程式为__________________________________________
__________________________________________。
(4)下列说法错误的是________。
A.化合物Ⅰ能发生银镜反应
B.苯乙烯发生加聚反应生成热固性塑料
C.苯乙醇能使酸性高锰酸钾溶液褪色
D.镍催化下,1 mol咖啡酸最多可加成4 mol H2

查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
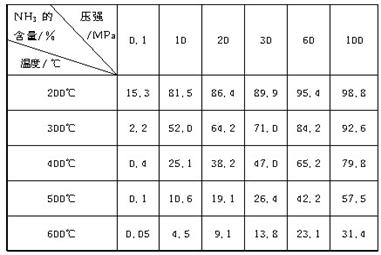
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用所作的判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C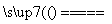 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2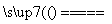 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C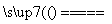 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的主要成分被消耗,用于雕刻玻璃
b.反应②中SiO2表现为氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④中SiO2将挥发性的酸酐从其盐中置换出来
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde
C.cde D.dab
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6- 2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低, 其原因是______________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是__________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是(双选)( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
H2S水溶液中存在电离平衡H2SH++HS-和HS-H++S2-。若向H2S溶液中 ( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO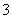 +H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
+H+的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com