
( 1·Ö) ĒāĘų»¹ŌŃõ»ÆĶµÄ·“Ó¦²»ĶźČ«Ź±£¬±ćµĆµ½Cu”¢Cu2O”¢CuOµÄ¹ĢĢå»ģŗĻĪļ”£»ÆѧŠĖȤŠ”×éĶ¬Ń§ĪŖĢ½¾æÉĻŹö¹ĢĢåµÄ³É·Ö½ųŠŠĮĖČēĻĀ²Ł×÷ŗĶŹµŃé£ŗ
(1)Č”Ņ»¶ØÖŹĮæµÄ¾łŌČ¹ĢĢå»ģŗĻĪļA£¬½«Ęä·Ö³ÉĮ½µČ·Ż”£
(2)Č”ĘäÖŠØD·ŻÓĆ×ćĮæµÄĒāĘų»¹Ō£¬²āµĆ·“Ó¦ŗó¹ĢĢåÖŹĮæ¼õÉŁ3.20g”£
(3)ĮķŅ»·Ż¼ÓČė500mLĻ”ĻõĖį£¬¹ĢĢåĒ”ŗĆĶźČ«Čܽā£¬ĒŅĶ¬Ź±ŹÕ¼Æµ½±ź×¼×“æöĻĀNOĘų
Ģå2.24L”£
Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
(1)AÖŠ£¬n(Cu)+n(Cu2O)£½ ”£
(2)AÖŠ£¬n(CuO)µÄȔֵ·¶Ī§ŹĒ ”£
(3)ŹŌ¼ĘĖćĖłÓĆĻ”ĻõĖįµÄĪļÖŹµÄĮæÅØ¶Č£ØŅŖĒóÓŠ¼ĘĖć¹ż³Ģ£©”£
 æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø Ķ¬²½ĶŲÕ¹ŌĶĮĻµĮŠ“š°ø
Ķ¬²½ĶŲÕ¹ŌĶĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

| ĪļÖŹ | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| ·Šµć/”ę | 57.7 | 12.8 | - | 315 | - |
| ČŪµć/”ę | -70.0 | -107.2 | - | - | - |
| Éż»ŖĪĀ ¶Č/”ę |
- | - | 180 | 300 | 162 |
| ·½°ø | Óŵć | ȱµć |
| ¼× | ¢ŁŹÕ¼Æ²śĘ·µÄµ¼¹Ü“Ö£¬²»»į¶ĀČūµ¼¹Ü ¢ŚĄäÄż²śĘ·£¬¼õÉŁ²śĘ·ĖšŹ§ ¢ŁŹÕ¼Æ²śĘ·µÄµ¼¹Ü“Ö£¬²»»į¶ĀČūµ¼¹Ü ¢ŚĄäÄż²śĘ·£¬¼õÉŁ²śĘ·ĖšŹ§ |
¢ŁæÕĘųÖŠµÄĖ®ÕōĘų½ųČė²śĘ·ŹÕ¼Æ×°ÖĆ£¬Ź¹ĖÄĀČ»Æ¹čĖ®½ā ¢ŚĪ²Ęųƻӊ“¦Ąķ£¬ĪŪČ¾»·¾³ ¢ŁæÕĘųÖŠµÄĖ®ÕōĘų½ųČė²śĘ·ŹÕ¼Æ×°ÖĆ£¬Ź¹ĖÄĀČ»Æ¹čĖ®½ā ¢ŚĪ²Ęųƻӊ“¦Ąķ£¬ĪŪČ¾»·¾³ |
| ŅŅ | ¢ŁÓŠĪ²Ęų“¦Ąķ×°ÖĆ£¬×¢ÖŲ»·±£ ¢Ś±ÜĆāæÕĘųÖŠµÄĖ®ÕōĘų½ųČė×°ÖĆ ¢ŁÓŠĪ²Ęų“¦Ąķ×°ÖĆ£¬×¢ÖŲ»·±£ ¢Ś±ÜĆāæÕĘųÖŠµÄĖ®ÕōĘų½ųČė×°ÖĆ |
¢Ł²śĘ·Ņ׶ĀČūµ¼¹Ü ¢ŚĆ»ÓŠĄäÄż×°ÖĆ£¬²śĘ·Ņ×ĖšŹ§ ¢Ł²śĘ·Ņ׶ĀČūµ¼¹Ü ¢ŚĆ»ÓŠĄäÄż×°ÖĆ£¬²śĘ·Ņ×ĖšŹ§ |
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğĖÄ“ØŹ”ĆąŃōŹŠøßČżµŚ¶ž“ĪÕļ¶ĻŠŌæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
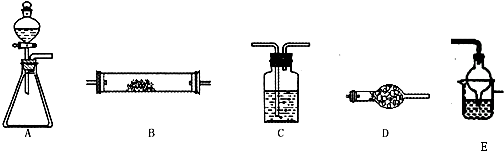
µ„¾§¹čŹĒŠÅĻ¢²śŅµÖŠÖŲŅŖµÄ»ł“”²ÄĮĻ”£¹¤ŅµÉĻæÉÓĆ½¹ĢæÓė¶žŃõ»Æ¹čµÄ»ģŗĻĪļŌŚøßĪĀĻĀÓėĀČĘų·“Ӧɜ³ÉSiCl4ŗĶCO£¬SiCl4¾Ģį“æŗóÓĆĒāĘų»¹ŌµĆøß“æ¹č”£ŅŌĻĀŹĒŹµŃéŹŅÖʱøSiCl4µÄ×°ÖĆŹ¾ŅāĶ¼”£

ŹµŃé¹ż³ĢÖŠ£¬ŹÆӢɰ֊µÄĢś”¢ĀĮµČŌÓÖŹŅ²ÄÜ×Ŗ»ÆĪŖĻąÓ¦ĀČ»ÆĪļ£¬SiCl4”¢AlCl3”¢FeCl3ÓöĖ®¾łŅ×Ė®½ā £¬ÓŠ¹ŲĪļÖŹµÄĪļĄķ³£Źż¼ūĻĀ±ķ£ŗ
£¬ÓŠ¹ŲĪļÖŹµÄĪļĄķ³£Źż¼ūĻĀ±ķ£ŗ
|
ĪļÖŹ |
SiCl4 |
AlCl3 |
FeCl3 |
|
·Šµć/”ę |
57.7 |
£ |
315 |
|
ČŪµć/”ę |
-70.0 |
£ |
£ |
|
Éż»ŖĪĀ¶Č/”ę |
£ |
180 |
300 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³ö×°ÖĆAÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_____________£¬ ×°ÖĆDµÄÓ²ÖŹ²£Į§¹ÜÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”£
 £Ø2£©×°ÖĆCÖŠµÄŹŌ¼ĮŹĒ
£» D”¢E¼äµ¼¹Ü¶ĢĒŅ“ÖµÄŌŅņŹĒ
ӣ
£Ø2£©×°ÖĆCÖŠµÄŹŌ¼ĮŹĒ
£» D”¢E¼äµ¼¹Ü¶ĢĒŅ“ÖµÄŌŅņŹĒ
ӣ
 £Ø3£©GÖŠĪüŹÕĪ²ĘųŅ»¶ĪŹ±¼äŗó£¬ĪüŹÕŅŗÖŠæĻ¶Ø“ęŌŚOH£”¢Cl£ŗĶSO42-”£ĒėÉč¼ĘŹµŃ飬Ģ½¾æøĆĪüŹÕŅŗÖŠæÉÄÜ“ęŌŚµÄĘäĖūĖįøłĄė×Ó£ØŗöĀŌæÕĘųÖŠCO2µÄÓ°Ļģ£©”£
£Ø3£©GÖŠĪüŹÕĪ²ĘųŅ»¶ĪŹ±¼äŗó£¬ĪüŹÕŅŗÖŠæĻ¶Ø“ęŌŚOH£”¢Cl£ŗĶSO42-”£ĒėÉč¼ĘŹµŃ飬Ģ½¾æøĆĪüŹÕŅŗÖŠæÉÄÜ“ęŌŚµÄĘäĖūĖįøłĄė×Ó£ØŗöĀŌæÕĘųÖŠCO2µÄÓ°Ļģ£©”£
”¾Ģį³ö¼ŁÉč”æ¼ŁÉč1£ŗÖ»ÓŠSO32-£»¼ŁÉč2£ŗ¼ČĪŽSO32-Ņ²ĪŽClO££»¼ŁÉč3£ŗ ”£
”¾Éč¼Ę·½°ø£¬½ųŠŠŹµŃé”ææɹ©Ń”ŌńµÄŹµŃéŹŌ¼ĮÓŠ£ŗ3 mol/L H2SO4”¢1 mol/L NaOH”¢0.01 mol/L KMnO4”¢äåĖ®”¢µķ·Ū-KI”¢Ę·ŗģµČČÜŅŗ”£
ȔɣĮæĪüŹÕŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼Ó3 mol/L H2SO4ÖĮČÜŅŗ³ŹĖįŠŌ£¬Č»ŗó½«ĖłµĆČÜŅŗ·ÖÖĆÓŚa”¢b”¢cČżÖ§ŹŌ¹ÜÖŠ£¬·Ö±š½ųŠŠĻĀĮŠŹµŃ锣ĒėĶź³ÉĻĀ±ķ£ŗ
|
ŠņŗÅ |
²Ł ×÷ |
æÉÄܳöĻÖµÄĻÖĻó |
½įĀŪ |
|
¢Ł |
ĻņaŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ |
ČōČÜŅŗĶŹÉ« |
Ōņ¼ŁÉč1³ÉĮ¢ |
|
ČōČÜŅŗ²»ĶŹÉ« |
Ōņ¼ŁÉč2»ņ3³ÉĮ¢ |
||
|
¢Ś |
ĻņbŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ |
ČōČÜŅŗĶŹÉ« |
Ōņ¼ŁÉč1»ņ3³ÉĮ¢ |
|
ČōČÜŅŗ²»ĶŹÉ« |
¼ŁÉč2³ÉĮ¢ |
||
|
¢Ū |
ĻņcŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ |
|
¼ŁÉč3³ÉĮ¢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014½ģ¹ć¶«Ź”ø߶žµŚŅ»½×¶Īæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(6·Ö)£Ø1£©°±Ęų“ß»ÆŃõ»ÆÉś²śĻõĖį,ĻõĖį³§³£ÓĆ“ß»Æ»¹Ō·Ø“¦ĄķĪ²Ęų:“߻ƼĮ“ęŌŚŹ±ÓĆH2½«NO2»¹ŌĪŖN2”£
ŅŃÖŖ:2H2(g)+O2(g)= 2H2O(g)””¦¤H=-483.6 kJ”¤mol-1
N2(g)+2O2(g)= 2NO2(g)””””¦¤H=+67.7 kJ”¤mol-1
ŌņH2»¹ŌNO2Éś³ÉĖ®ÕōĘų·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ”””””””””””””””””””””” ”£
£Ø2£©µŖĘųŗĶĒāĘųŗĻ³É°±ŹĒ»Æѧ¹¤ŅµÖŠ¼«ĪŖÖŲŅŖµÄ·“Ó¦,ĘäČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ:N2(g)+3H2(g) 2NH3(g)””¦¤H=-92
kJ”¤mol-1”£Ēė»Ų“šĻĀĮŠĪŹĢā:
2NH3(g)””¦¤H=-92
kJ”¤mol-1”£Ēė»Ų“šĻĀĮŠĪŹĢā:
¢ŁČ”1 mol N2(g)ŗĶ3 mol H2(g)·ÅŌŚŅ»ĆܱÕČŻĘ÷ÖŠ,ŌŚ“߻ƼĮ“ęŌŚŹ±½ųŠŠ·“Ó¦,²āµĆ·“Ó¦·Å³öµÄČČĮæ””””””92 kJ(Ģī”°“óÓŚ”±”°µČÓŚ”±»ņ”°Š”ÓŚ”±),ŌŅņŹĒ””””””””””””””””””””””””””””””£»
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com