
”¾»Æѧ”ŖŃ”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ”æČĖĄąŌŚŹ¹ÓĆ½šŹōµÄĄśŹ·½ų³ĢÖŠ£¬¾ĄśĮĖĶ”¢Ģś”¢ĀĮÖ®ŗó,µŚĖÄÖÖ½«±»¹ć·ŗÓ¦ÓĆµÄ½šŹō±»æĘѧ¼ŅŌ¤²āŹĒīŃ£ØTi£©£¬Ėü±»ÓžĪŖ”°Ī“Ą“ŹĄ¼ĶµÄ½šŹō”±.ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©TiŌŖĖŲŌ×ÓŠņŹżĪŖ22£¬ĖüŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒµŚ ÖÜĘŚµŚ ×壻Ę仳Ģ¬Ō×ӵĵē×ÓÅŲ¼Ź½ĪŖ ”£
£Ø2£©ŌŚTiµÄ»ÆŗĻĪļÖŠ£¬æÉŅŌ³ŹĻÖ+2”¢+3”¢+4ČżÖÖ»ÆŗĻ¼Ū£¬ĘäÖŠŅŌ+4¼ŪµÄTi×īĪŖĪČ¶Ø£®Ę«īŃĖį±µµÄČČĪČ¶ØŠŌŗĆ£¬½éµē³£Źżøߣ¬ŌŚŠ”ŠĶ±äŃ¹Ę÷”¢»°Ķ²ŗĶĄ©ŅōĘ÷ÖŠ¶¼ÓŠÓ¦ÓĆ£®Ę«īŃĖį±µ¾§ĢåÖŠ¾§°ūµÄ½į¹¹Ź¾ŅāĶ¼ČēĶ¼1ĖłŹ¾£¬ĖüµÄ»ÆѧŹ½ŹĒ £¬ĘäÖŠTi4+µÄŃõÅäĪ»ŹżĪŖ £¬Ba2+µÄŃõÅäĪ»ŹżĪŖ ”£
£Ø3£©³£ĪĀĻĀµÄTiCl4ŹĒÓŠ“Ģ¼¤ŠŌ³ōĪ¶µÄĪŽÉ«ĶøĆ÷ŅŗĢ壬ČŪµć©23.2”ę£¬·Šµć136.2”ę£¬ĖłŅŌTiCl4Ó¦ŹĒ
»ÆŗĻĪļ£¬Ęä¹ĢĢåŹĒ ¾§Ģ唣TiCl4ŌŚ³±ŹŖæÕĘųÖŠŅ×»Ó·¢£¬Ė®½ā¶ųĆ°°×ŃĢ£¬ÕāŹĒŅņĪŖĖ®½āŗóÓŠ Éś³É”£
£Ø4£©ŅŃÖŖTi3+æÉŠĪ³ÉÅäĪ»ŹżĪŖ6µÄÅäŗĻĪļ£¬Ęäæռ乹ŠĶĪŖÕż°ĖĆęĢ壬ČēĶ¼2ĖłŹ¾£¬ĪŅĆĒĶس£æÉŅŌÓĆĶ¼3ĖłŹ¾µÄ·½·ØĄ“±ķŹ¾Ęäæռ乹ŠĶ£ØĘäÖŠA±ķŹ¾ÅäĢ壬M±ķŹ¾ÖŠŠÄŌ×Ó£©”£ÅäĪ»»ÆŗĻĪļ[Co(NH3)4Cl2]µÄæռ乹ŠĶŅ²ĪŖ°ĖĆęĢåŠĶ£¬ĖüÓŠ ÖÖĶ¬·ÖŅģ¹¹Ģ壬Ēė½«Ęä½į¹¹»³ö_________________”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 10mL0.1mol/LµÄAlCl3ČÜŅŗ | B£® | 20mL0.2mol/LµÄCaCl2ČÜŅŗ | ||
| C£® | 30mL0.2mol/LµÄKClČÜŅŗ | D£® | 10mL0.25mol/LµÄNaClČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚ0.lmol/LµÄCH3COOHČÜŅŗÖŠ“ęŌŚČēĻĀµēĄėĘ½ŗā£ŗ
CH3COOH CH3COO££«H£«¶ŌÓŚøĆĘ½ŗā£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
CH3COO££«H£«¶ŌÓŚøĆĘ½ŗā£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A£®¼ÓČėÉŁĮæNaOH¹ĢĢå£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ
B£®¼ÓĖ®£¬·“Ó¦ĖŁĀŹŌö“ó£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅʶÆ
C£®µĪ¼ÓÉŁĮæ0.l mol / L HClČÜŅŗ£¬ČÜŅŗÖŠc?H£«?¼õÉŁ
D£®¼ÓČėÉŁĮæCH3COONa¹ĢĢå£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ°²»ÕŹ”»ĘɽŹŠøßČżÉĻŌĀ漶ž»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³£ĪĀĻĀ£¬ÓŠĻĀĮŠĖÄÖÖČÜŅŗ£ŗ
¢Ł | ¢Ś | ¢Ū | ¢Ü |
0.1 mol/L NaOHČÜŅŗ | pH = 11 NaOHČÜŅŗ | 0.1 mol/L CH3COOHČÜŅŗ | pH = 3 CH3COOHČÜŅŗ |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®ÓÉĖ®µēĄė³öH+µÄÅضČc(H+)£ŗ¢Ł£¾¢Ū
B£®½«¢Ü¼ÓÕōĮóĖ®Ļ”ŹĶÖĮŌĄ“µÄ100±¶Ź±£¬ĖłµĆČÜŅŗµÄpH=5
C£®¢ŁÓė¢Ū»ģŗĻ£¬ČōČÜŅŗpH=7£¬ŌņĢå»ż£ŗV(NaOH)£¾V(CH3COOH)
D£®½«¢ŚÓė¢ÜµČĢå»ż»ģŗĻ£¬ČōČÜŅŗpH<7£¬ø÷Ąė×ÓÅØ¶ČµÄ¹ŲĻµĪŖ£ŗ
c(CH3COO£)+c(OH£)=c(Na+)+c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ°²»ÕŹ”»ĘɽŹŠøßČżÉĻŌĀ漶ž»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
øų¶ØĢõ¼žĻĀ£¬ĻĀĮŠŃ”ĻīÖŠĖłŹ¾µÄĪļÖŹ¼ä×Ŗ»Æ¾łÄÜŅ»²½ŹµĻֵďĒ£Ø £©
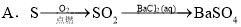
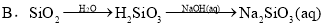
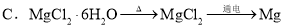

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģÖŲĒģŅ»ÖŠøßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
½«0.4 g NaOHŗĶ1.06 g Na2CO3 »ģŗĻ²¢Åä³ÉČÜŅŗ£¬ĻņČÜŅŗÖŠµĪ¼Ó0.1 mol”¤L-1Ļ”ŃĪĖį”£ĻĀĮŠĶ¼ĻńÄÜÕżČ·±ķŹ¾¼ÓČėŃĪĖįµÄĢå»żŗĶÉś³ÉCO2µÄĪļÖŹµÄĮæµÄ¹ŲĻµµÄŹĒ
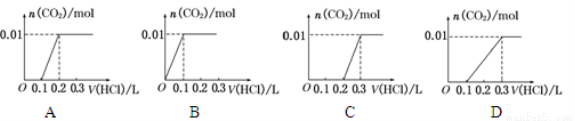
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
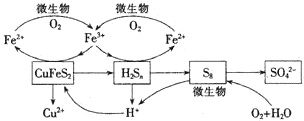 ĪŅ¹ś²śĶÖ÷ŅŖČ”×Ō»ĘĶæó£ØCuFeS2£©£¬Ėę×ÅæóŹÆĘ·Ī¶µÄ½µµĶŗĶ»·±£ŅŖĒóµÄĢįøߣ¬ŹŖ·ØĮ¶ĶµÄÓÅŹĘČÕŅęĶ»³ö£®øĆ¹¤ŅÕµÄŗĖŠÄŹĒ»ĘĶæóµÄ½ž³ö£¬ÄæĒ°Ö÷ŅŖÓŠŃõ»Æ½ž³ö”¢ÅäĪ»½ž³öŗĶÉśĪļ½ž³öČżÖÖ·½·Ø£®
ĪŅ¹ś²śĶÖ÷ŅŖČ”×Ō»ĘĶæó£ØCuFeS2£©£¬Ėę×ÅæóŹÆĘ·Ī¶µÄ½µµĶŗĶ»·±£ŅŖĒóµÄĢįøߣ¬ŹŖ·ØĮ¶ĶµÄÓÅŹĘČÕŅęĶ»³ö£®øĆ¹¤ŅÕµÄŗĖŠÄŹĒ»ĘĶæóµÄ½ž³ö£¬ÄæĒ°Ö÷ŅŖÓŠŃõ»Æ½ž³ö”¢ÅäĪ»½ž³öŗĶÉśĪļ½ž³öČżÖÖ·½·Ø£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µĄ¶ū¶ŁĢį³öŌ×ÓѧĖµ£¬ĆŽŻĮŠ·ņ·¢ĻÖŌŖĖŲÖÜĘŚĀÉ | |
| B£® | »Æѧъ¾æµÄÖ÷ŅŖÄæµÄ¾ĶŹĒČĻŹ¶·Ö×Ó | |
| C£® | ŃŠ¾æĪļÖŹµÄŠŌÖŹ£¬³£³£ŌĖÓĆ¹Ū²ģ”¢ŹµŃ锢·ÖĄą”¢±Č½ĻµČ·½·Ø | |
| D£® | »Æѧ¼ŅæÉŅŌŌŚĪ¢¹Ū²ćĆęÉĻ²Ł×Ż·Ö×ÓŗĶŌ×Ó£¬×é×°·Ö×Ó²ÄĮĻ”¢·Ö×ÓĘ÷¼žŗĶ·Ö×Ó»śĘ÷ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com