
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 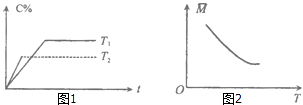
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 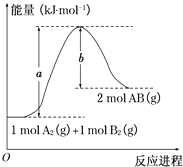
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理.已知:NCl3熔点为﹣40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应.实验室中可用氯气和氨气反应制取NCl3 , 反应方程式为4NH3+3C12 ![]() NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式: . 写出A装置中的试管内发生的反应的化学方程式:
(2)E中的试剂为;B中的试剂为
(3)导管G末端应连接的装置为图中的(填选项字母). 
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,另一种有强氧化性,可使有色物质褪色.写出NCl3水解的化学方程式: .
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)恒温下,容积均为2L的密闭容器M,N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3mol A、2mol B;2min达平衡,生成D 1.2mol,测得从反应开始到平衡C的速率为0.3mol(Lmin)﹣1 . N:2mol C,y mol D;达平衡时c(A)=0.6molL﹣1 . 下列推断的结论中不正确的是( )
A.x=2
B.平衡时M中c(A)<0.6 mol/L
C.y>0.8
D.M,N达到平衡时容器中各物质浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32﹣、AlO2﹣、CO32﹣、Cl﹣中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( ) 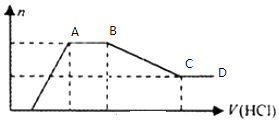
A.溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣
B.OA段参加反应的阴离子的物质的量之比为2:1或1:2
C.AB段一定生成了气体
D.BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气是一种低热值煤气,主要成分为H2和CO,主要作为工业上合成氨和液体燃料的原料.
(1)反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41KJ/mol的v﹣t图象如图1所示,若其他条件不变,只是在反应前缩小体积使压强增大,则其v﹣t图象如图2所示. 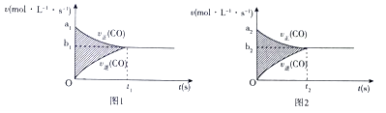
下列说法正确的是
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图2阴影部分面积更大
A.①④⑤⑦
B.①③⑥⑦
C.②④⑤⑧
D.②④⑤⑦
(2)在一定温度下将C单质和CO2(g)各0.10mol充入体积为1L的恒容密闭容器中发生反应C(s)+CO2(g)2CO(g)△H=+172KJ/mol.
①下列示意图正确且能说明反应在t1时刻已经达到化学平衡状态的是(填序号).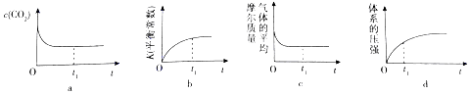
②达到平衡时,容器内的压强为起始时的1.5倍,则此时反应的化学平衡常数K=;若此时再分别加入0.05mol的CO2和0.1mol的CO,则此时平衡将(填“左移”、“右移”或“不移动”.)若将该反应的起始条件改为恒温恒压,则达到平衡时,CO2的转化率将(填“增大”“减小”或“不变”).
(3)工业上用焦炭和水蒸气制备水煤气的热化学方程式为
(4)在一定条件下以CO和H2为原料可以合成乙醇,反应方程式为:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H=aKJ/mol.
请从反应能否自发进行的角度解释a一定小于0的原因: , 若只改变反应的一个条件,能使平衡体系中n ![]() 增大的措施有(答出两点即可)
增大的措施有(答出两点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A,B,C,D,E,X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( ) ![]()
A.若D是一种强碱,则A,B,C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com