
【题目】某课外活动小组做了如下关于钠的探究实验。
探究一:钠与水反应
![]() 该反应的离子方程式_______________________________。
该反应的离子方程式_______________________________。
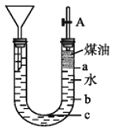
![]() 用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为
用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为![]() 液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
![]() 若实验室要配制480mL0.
若实验室要配制480mL0.![]() NaOH溶液。
NaOH溶液。
①需______gNaOH。
②配制过程中,所用的玻璃仪器除玻璃棒、容量瓶、胶头滴管外,还有______。
③列操作会使所配NaOH溶液浓度偏小的是______(填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后,发现凹液面低于刻度线又加水补上
探究二:钠与氯气反应
![]() 钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
![]() 在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下
在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下![]() Cl2,则作还原剂的HCl的物质的量是______。
Cl2,则作还原剂的HCl的物质的量是______。
![]() 粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④用适量盐酸调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发 正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
【答案】2Na+ 2H2O=2Na++ 2OH-+ H2↑ a 6.0 烧杯 CD 白烟 1mol ad
【解析】
⑹把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉。
⑴钠和水反应生成氢氧化钠和氢气,化学方程式为![]() ,离子方程式为
,离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
⑵钠的密度比煤油的大,比水的小,所以钠应该在煤油和水的分界线处,故答案为:a;
⑶①配置480mL溶液,没有480mL的容量瓶,只能用500mL的容量瓶,氢氧化钠的质量以500mL来计算,氢氧化钠的物质的量![]() , 氢氧化钠质量
, 氢氧化钠质量![]() ,故答案为:6.0;
,故答案为:6.0;
②在溶解氢氧化钠时还需要烧杯,故答案为:烧杯;
③A.加水定容时,俯视刻度线会导致最终溶液体积偏小,浓度偏大,故A错误;
B.容量瓶的内壁附有水珠而未干燥处理,不会影响最终浓度的大小,故B错误
C. 在溶解过程中有少量液体溅出烧杯外,损失了溶质,最终溶液的体积不变,所以浓度会偏小,故C正确;
D. 颠倒摇匀后,凹液面低于刻度线,是由于配好的溶液附着在瓶塞和瓶壁上,溶液已经配好,再加水相当于稀释溶液,使溶液浓度偏低,故D正确;
故答案为:CD。
⑷钠在氯气中燃烧现象:剧烈燃烧,火焰呈黄色,且有白烟生成,故答案为:白烟;
⑸标准状况下11.2L![]() 的物质的量为
的物质的量为![]()
则: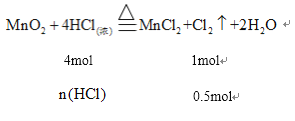
解得![]() ,被氧化的
,被氧化的![]() 做还原剂生成
做还原剂生成![]() ,做还原剂的
,做还原剂的![]() 的物质的量是参加反应的盐酸量的一半,所以做还原剂的
的物质的量是参加反应的盐酸量的一半,所以做还原剂的![]() 为
为![]() ,故答案为:
,故答案为:![]() ;
;
⑹除去粗盐中的可溶性的杂质:![]() 、
、![]() 、
、![]() 时,先加入过量
时,先加入过量![]() 除去
除去![]()
![]() ,再加入过量
,再加入过量![]() 除去
除去![]()
![]() ,加入过量的
,加入过量的![]() 除去
除去![]() 和多余的
和多余的![]() ,
,![]() 、
、![]() ,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡的顺序可以颠倒,过滤后再加盐酸调节pH等于7,以防沉淀溶解,正确操作顺序为⑤②③①⑥④⑦或⑤③②①⑥④⑦,故答案为:ad;
,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡的顺序可以颠倒,过滤后再加盐酸调节pH等于7,以防沉淀溶解,正确操作顺序为⑤②③①⑥④⑦或⑤③②①⑥④⑦,故答案为:ad;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与能量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)燃烧热的热化学方程式为CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.拆开化学键需要吸收能量,形成化学键会释放能量
D.化学电池是把化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式是: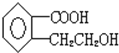 它可以通过不同的反应得到下列物质:
它可以通过不同的反应得到下列物质:
![]() 则1mol的该有机物跟足量的金属钠反应可以产生 ______
则1mol的该有机物跟足量的金属钠反应可以产生 ______ ![]() ,1mol该有机物可以跟 ______
,1mol该有机物可以跟 ______ ![]() 反应,1mol该有机物可以跟 ______ molNaOH反应。
反应,1mol该有机物可以跟 ______ molNaOH反应。
![]() 中官能团的名称是: ______ 。
中官能团的名称是: ______ 。
![]() 写出C在一定条件下反应,生成高分子化合物的化学方程式及反应类型: ______ , ______ 。
写出C在一定条件下反应,生成高分子化合物的化学方程式及反应类型: ______ , ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
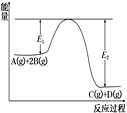
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如下图所示。下列说法不正确的是( )。
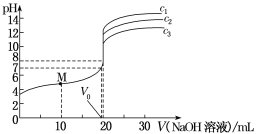
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)=![]() [c(A-)-c(HA)]+c(OH-)
[c(A-)-c(HA)]+c(OH-)
C.恰好中和时,三种溶液的pH相等
D.由pH=7的溶液计算得:Ka=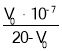 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜反应的离子方程式____________________
(2)某小组采取下列步骤从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液。
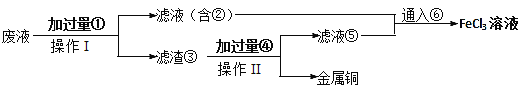
操作Ⅰ和Ⅱ的操作使用到的主要玻璃仪器有____,滤渣③含有的单质有______。通入气体⑥的化学式为______。
(3)若某腐蚀液中含1.5mol·L-1CuCl2、3.0mol·L-1FeCl2、1.0mol·L-1FeCl3,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R.F.Heck、Ei-ichiNegishi和AkiraSuzuk三名科学家因在钯(Pd)催化交叉偶联反应方面的卓越研究获得2010年诺贝尔化学奖,其中Heck反应的历程如图,下列说法错误的是
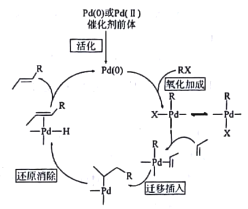
A.Heck反应的总反应类型为取代反应
B.![]() 三中最多有6个原子共平面
三中最多有6个原子共平面
C.![]() 可使溴水或酸性KMnO4溶液褪色
可使溴水或酸性KMnO4溶液褪色
D.若RX为CH3CH2Br,则![]() 的同类别同分异构体还有4种(不考虑立体异构)
的同类别同分异构体还有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素形成的有机化合物在动植物体内及人类生存环境中有着相当广泛的存在,起着非常重要的作用。请结合下列有关含碳化合物的研究,完成下列填空。
(1)为了高效利用能源并且减少CO2的排放,可用下列方法把CO2转化成甲醇燃料:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=akJmol1
②2H2(g)+O2(g)=2H2O(g) △H=bkJmol1
③CH3OH(g)=CH3OH(l) △H=ckJmol1
④H2O(g)=H2O(l) △H=dkJmol1
则表示CH3OH(l)燃烧热的热化学方程式为___。
(2)用甲醇燃料电池电解处理酸性含铬废水(主要含有Cr2O72),用如图装置模拟该过程:
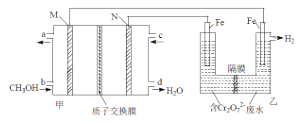
①请完成电解池中Cr2O72转化为Cr3+的离子方程式___。
②当甲池中消耗甲醇1.6g时,乙池中两电极的质量差为___g。
(3)葡萄糖和果糖为同分异构体,在一定条件下,C6H12O6(葡萄糖)![]() C6H12O6(果糖) △H﹤0。该反应的速率方程式可表示为v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定温度下为常数,分别称作正、逆反应速率常数。T1温度下,k(正)=0.06s1,k(逆)=0.002s1。
C6H12O6(果糖) △H﹤0。该反应的速率方程式可表示为v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定温度下为常数,分别称作正、逆反应速率常数。T1温度下,k(正)=0.06s1,k(逆)=0.002s1。
①T1温度下,该反应的平衡常数K1=___。
②该反应的活化能Ea(正)___Ea(逆)(填“大于”、“小于”或“等于”)。
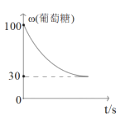
③该T2温度下,从开始反应到平衡的过程中,葡糖糖的质量分数变化如图所示。可以确定温度T2___T1(填“大于”、“小于”或“等于”)。
(4)H2A为二元弱酸。室温下配制一系列c(H2A)+c(HA)+c(A2)=0.100molL1的H2A与NaOH的混合溶液。测得H2A、HA、A2的物质的量分数c(x)%(c(x)%=![]() ×100%)随pH变化如图所示。
×100%)随pH变化如图所示。
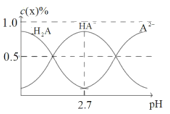
①当c(Na+)=0.100molL1时,溶液中离子浓度的大小顺序为___。
②室温下,若将0.100molL1的H2A与amolL1的NaOH溶液等体积混合,使溶液的pH=7。则H2A的Ka2=___molL1(用a表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com