
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化不一定都是化学反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是大于生成物的总能量 |
分析 A、化学反应发生物质变化的同时一定发生能量变化;
B、伴有能量变化的物质变化既有物理变化又有化学变化;
C、反应物的总能量与生成物的总能量不同导致化学反应伴随能量变化;
D、反应物的总能量总是高于生成物的总能量,反应是放热反应.
解答 解:A.化学变化的本质是旧键断裂、新键生成,化学变化不仅由新物质生成,同时一定伴随能量变化,故A正确;
B、伴有能量变化的物质变化不一定是化学变化,物质发生物理变化、核变化(如原子弹的爆炸)也都伴有能量变化,故B正确;
C、化学反应发生物质变化的同时一定发生能量变化,反应物的总能量与生成物的总能量不同导致化学反应都伴随能量变化,所以在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同,故C正确;
D、化学反应有吸热反应也有放热反应,反应物的总能量总是高于生成物的总能量,反应是放热反应,在一个确定的化学反应关系中,反应物的总能量不一定总是高于生成物的总能量,故D错误;
故选:D.
点评 本题主要考查了化学反应中能量变化的原因,抓住化学变化的本质是旧键断裂、新键生成,化学变化不仅由新物质生成,同时一定伴随能量变化即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
 CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.
CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 使用CCl4提取碘水中的碘 | 萃取、分液 | 碘在CCl4中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去淀粉胶体中的NaCl | 过滤 | 淀粉胶体不能透过滤纸 |
| D | 分离氯化钠和氯化铵 | 升华 | 氯化铵易升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{9a}$ mol-1 | B. | 9a mol-1 | C. | 2a mol-1 | D. | 18a mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.2g | B. | 7.3g | C. | 3.65g | D. | 7.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
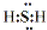 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com