
【题目】人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
(1)铅蓄电池在放电时的电池反应为![]() ,则其正极上的电极反应为_____。
,则其正极上的电极反应为_____。
(2)![]() 溶液腐蚀印刷电路铜板时发生反应:
溶液腐蚀印刷电路铜板时发生反应:![]() 。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:____;当电路中转移0.2mol电子时,被腐蚀的铜的质量为_____g。
。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:____;当电路中转移0.2mol电子时,被腐蚀的铜的质量为_____g。
(3)已知甲醇燃料电池的工作原理如图所示。该电池工作时,b口通入的物质为___,该电池正极上的电极反应式为__;当6.4g甲醇(![]() )完全反应生成
)完全反应生成![]() 时,有___mol电子发生转移。
时,有___mol电子发生转移。

【答案】![]() Cu Cu-2e-=Cu2+ 6.4
Cu Cu-2e-=Cu2+ 6.4 ![]() O2+4H++4e-=2H2O 1.2
O2+4H++4e-=2H2O 1.2
【解析】
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,结合原电池工作原理和有关物质的性质分析解答。
(1)铅蓄电池在放电时的电池反应为![]() ,反应中二氧化铅得到电子,作正极,则其正极上的电极反应为
,反应中二氧化铅得到电子,作正极,则其正极上的电极反应为![]() 。
。
(2)![]() 溶液腐蚀印刷电路铜板时发生反应:
溶液腐蚀印刷电路铜板时发生反应:![]() ,反应中铜失去电子,因此若将此反应设计成原电池,则负极所用的电极材料为Cu,电极反应式为Cu-2e-=Cu2+;当电路中转移0.2mol电子时,被腐蚀的铜的物质的量是0.1mol,质量为6.4g。
,反应中铜失去电子,因此若将此反应设计成原电池,则负极所用的电极材料为Cu,电极反应式为Cu-2e-=Cu2+;当电路中转移0.2mol电子时,被腐蚀的铜的物质的量是0.1mol,质量为6.4g。
(3)根据装置图可知氢离子向右侧移动,所以右侧电极是正极,左侧是负极,则该电池工作时,b口通入的物质为![]() ,氧气在正极上发生得到电子的还原反应,因此该电池正极上的电极反应式为O2+4H++4e-=2H2O;6.4g甲醇(
,氧气在正极上发生得到电子的还原反应,因此该电池正极上的电极反应式为O2+4H++4e-=2H2O;6.4g甲醇(![]() )的物质的量是0.2mol,反应中碳元素化合价从-2价升高到+4价,失去6个电子,因此完全反应生成
)的物质的量是0.2mol,反应中碳元素化合价从-2价升高到+4价,失去6个电子,因此完全反应生成![]() 时,有1.2mol电子发生转移。
时,有1.2mol电子发生转移。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧的过程中会释放大量的SO2,严重破坏生态环境,采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率,相关反应的热化学方程式如下:CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJmol﹣1(反应Ⅰ),CaSO4(s)+4CO(g)CaS(s)+4CO2(g) △H2=﹣175.6kJmol﹣1(反应Ⅱ),假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池,电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1mol CH4,可以向外电路提供约![]()
![]() 的电量;
的电量;
②负极上CH4失去电子,电极反应式为: CH4-8e-+10OH—=CO32-+7H2O
③负极上是O2获得电子,电极反应式为![]() ;
;
④电池放电后,溶液pH不断升高
A.①②B.①③C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:

(1)操作①的名称是:___________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①为了提高NaOH和铝土矿的反应速率可采取哪些措施__________________________(写两条)。
(3)图中①的离子方程式_____________________________________________________________;图中③、④的化学反应方程式______________________________________________________。
(4)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B. 反应①、过滤后所得沉淀为Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 试剂X可以是氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. C6H14所有的同分异构体中主链为4个碳的只有2种
B. CH3CO18OCH2CH3在酸性条件下水解能得到CH3CH218OH
C. 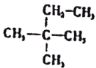 的名称是2-甲基-2-乙基丙烷
的名称是2-甲基-2-乙基丙烷
D. ![]() 与
与![]() 是同一种物质
是同一种物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com