
对“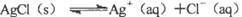 ”的理解正确的是( )。
”的理解正确的是( )。
| A.说明AgCl没有完全电离,AgCl是弱电解质 |
| B.说明溶解的AgCl已完全电离,AgCl是强电解质 |
| C.说明Ag+与Cl-的反应不能完全进行到底 |
| D.说明Ag+与Cl-的反应可以完全进行到底 |
科目:高中化学 来源: 题型:单选题
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)="10.00" mL 时,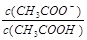 <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
250C时,0.1mol·L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )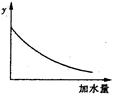
| A.溶液的pH | B.醋酸的电离平衡常数 |
| C.溶液的导电能力 | D.醋酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 ( )
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示: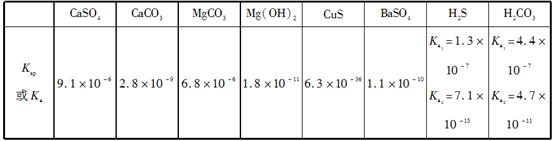
则下列说法不正确的是( )
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
| D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO3—+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列有关醋酸溶液的叙述中不正确的是( )
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| C.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)减小 |
| D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能说明醋酸是弱电解质的是
| A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液 |
| B.用食醋可以除热水瓶内的水垢 |
| C.pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D.用浓H2SO4和醋酸钠固体共热可制得醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-)。则下列关系中一定正确的是( )
| A.c(Na+)+c(H+)=c(HB-)+2c(B2-) | B.c(H+)·c(OH-)=10-14 |
| C.c(Na+)=c(B2-)+c(HB-) | D.溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是( )
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42—)较原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42—)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42—)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42—)较原来的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com