
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |



科目:高中化学 来源: 题型:
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、涤纶、塑料、光导纤维都是有机高分子材料 |
| C、用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D、外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、放电过程电子从正极流向负极 |
| C、放电时溶液中正极附近OH-浓度变小 |
| D、充电时电解质溶液中的OH-向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示pH相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| B、图1表示物质的量浓度相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| C、图2中,t℃时饱和溶液的质量分数为m% |
| D、图2中,若保持温度不变,可以通过添加溶质的方法使溶液组成从a点变为b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
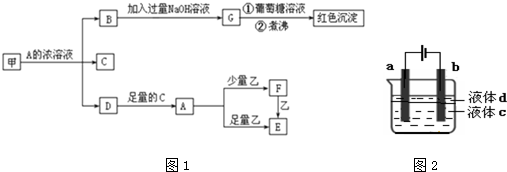
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
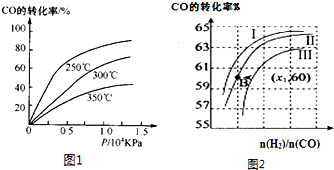
| n(H2) |
| n(CO) |
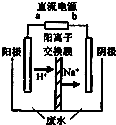
查看答案和解析>>
科目:高中化学 来源: 题型:
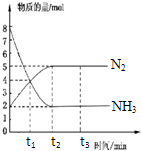 在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )
在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )| A、t1时反应达到平衡 |
| B、t3时,v正(N2)>v逆(N2) |
| C、t2时和t3时n(H2)相等 |
| D、t3后,若体积不变充He,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com