
分析 (1)根据盖斯定律,结合题中给出的热化学方程式写Al(s)的单质和FeO(s)反应的热化学方程式;
(2)根据燃烧热的概念,计算1mol甲醇燃烧放出的热量写热化学方程式;
(3)根据每生成23gNO2即0.5molNO2需要吸收16.95kJ热量,结合热化学方程式的书写方法结合热化学方程式的意义来回答.
解答 解:(1)已知:①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H=-272.0KJ/mol,
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1675.7KJ/mol,
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1;
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.76KJ,所以甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
(3)适量的N2和O2完全反应,每生成23克NO2即0.5molNO2要吸收16.95kJ热量,所以每生成2molNO2需要吸收67.8kJ热量,则热化学方程式为:
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1.
点评 本题考查了盖斯定律,根据题给方程式进行整合得出目标方程式,反应热进行相应的改变,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2CO(g)═2C(s)+O2(g) | B. | NH4Cl(s)=NH3(g)+HCl(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 温度(℃) | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | X |
| 3 | 110 | 0.8 | Y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
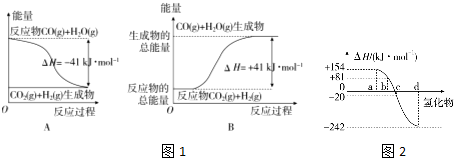
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| B. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| C. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| D. |  与 与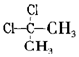 互为同分异构体 互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com