


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
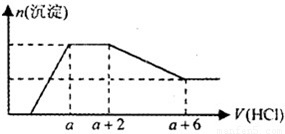
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
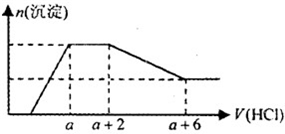
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
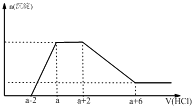 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )| A、不含SO42- | B、含有的阴离子一定是OH-、AlO2-、SiO32- | C、含有的阴离子一定是OH-、CO32-、AlO2-、SiO32- | D、含有AlO2-与SiO32-的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
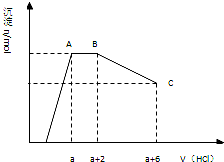
(6分)某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
回答下列问题:(已知:AlO2-+HCO3-+H2O=Al(OH)3↓+ CO32-)
(1)原混合溶液中一定含有的离子是:___________________________________;
(2)AB段反应的离子方程式是:____________________________________________;
(3)发生AB段反应的离子与发生BC段反应的物质两者物质的量之比为:____________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三第二次质量检测化学试卷(解析版) 题型:选择题
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化的如下图所示,下列说法正确的是( )

A、原溶液一定含有Na2SO4
B、反应最后形成的溶液中的溶质为NaCl
C、原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32-
D、原溶液中含有CO32- 与AlO2-的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com