
分析 (1)硫酸钡不溶于稀硝酸,则不溶物为BaSO4;碳酸钠与氯化钡反应生成碳酸钡沉淀,CO32-+Ba2+═BaCO3↓;硫酸钠与氯化钡反应生成硫酸钡沉淀:SO42-+Ba2+=BaSO4↓;碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳气体和水:BaCO3+2H+=Ba2++H2O+CO2↑;
(2)碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据质量守恒得:n(Na2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol;碳酸钡的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为:$\frac{9.85g}{197g/mol}$=0.05mol,根据质量守恒可知:n(Na2CO3)=n(BaCO3)=0.05mol,然后根据m=nM计算出硫酸钠、碳酸钠的质量,再分别计算出二者的质量分数.
解答 解:(1)碳酸钡溶于稀硝酸,而硫酸钡不溶,则不溶物为BaSO4;
碳酸钠与氯化钡反应生成碳酸钡沉淀,反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl,离子方程式为:CO32-+Ba2+═BaCO3↓;
硫酸钠与氯化钡反应生成硫酸钡沉淀,反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl,离子方程式为:SO42-+Ba2+=BaSO4↓;
碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳气体和水,反应的离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,
答:有关的离子方程式为:CO32-+Ba2+═BaCO3↓、SO42-+Ba2+=BaSO4↓、BaCO3+2H+=Ba2++H2O+CO2↑;
(2)碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据质量守恒得:n(Na2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,则硫酸钠的质量为:142g/mol×0.02mol=2.84g,混合液中硫酸钠的质量分数为:$\frac{2.84g}{50g}$×100%=5.68%;
碳酸钡的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为:$\frac{9.85g}{197g/mol}$=0.05mol,根据质量守恒可知:n(Na2CO3)=n(BaCO3)=0.05mol,则碳酸钠的质量为:106g/mol×0.05mol=0.53g,碳酸钠的质量分数为:$\frac{0.53g}{50g}$×100%=1.06%,
答:原混合溶液中Na2CO3和Na2SO4的质量分数分别为1.06%、5.68%.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
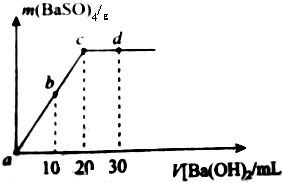 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )| A. | Ba(OH)2的物质的量浓密度为0.35mol/L | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.175mol/L | |
| C. | c时刻溶液显中性 | |
| D. | 实验过程中a、b、c三处溶液的导电能力c<b<a |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 铜与浓硫酸混合加热:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+2H2O+SO2↑ | |
| C. | 过量的浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
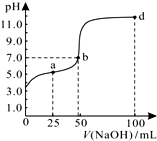 常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L NaOH溶液,混合溶液的pH变化情况如右图所示.下列判断正确的是( )
常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L NaOH溶液,混合溶液的pH变化情况如右图所示.下列判断正确的是( )| A. | 由图中信息可知,HA可能为强酸 | |
| B. | a点对应的溶液中:2c(Na+)=c(A-)+c(HA) | |
| C. | b点对应的溶液中:c(Na+)=c(A-)+c(HA) | |
| D. | d点所对应的溶液中离子浓度的大小关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cn元素的相对原子质量为277 | |
| B. | 277112Cn的原子核内中子数比质子数多53 | |
| C. | 上述合成过程中属于化学变化 | |
| D. | Cn元素位于元素周期表的第六周期,是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌片是原电池负极 | B. | 铜片质量逐渐减少 | ||
| C. | H+在负极得到电子被还原 | D. | 电流从锌片经导线流向铜片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com