
| A. | 水晶和干冰的熔化 | B. | 食盐和冰醋酸熔化 | ||
| C. | 液溴和金刚石的气化 | D. | 纯碱和烧碱的熔化 |
分析 分子晶体中存在分子间作用力,离子晶体中存在离子键,原子晶体中存在共价键,金属晶体中存在金属键,根据晶体类型分析解答.
解答 解:A、水晶是原子晶体和干冰是分子晶体,两者熔化时分别克服共价键和分子作用力,故A错误;
B、食盐是离子晶体和冰醋酸是分子晶体,两者熔化时分别克服离子键和分子作用力,故B错误;
C、液溴是分子晶体和金刚石是原子晶体,两者气化时分别克服分子作用力和共价键,故C错误;
D、纯碱和烧碱都是离子晶体,熔化时都克服离子键,故D正确;
故选D.
点评 本题考查化学键判断,明确物质的构成微粒及微粒之间的作用力即可解答,注意原子晶体熔融时破坏共价键不是分子间作用力,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制半导体材料的元素 | B. | 制催化剂的元素 | ||
| C. | 制农药的元素 | D. | 制耐高温合金的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙<丁<戊 | |
| B. | 金属性:甲>乙 | |
| C. | 最外层电子数:甲>乙 | |
| D. | 最高价氧化物的水化物的碱性:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
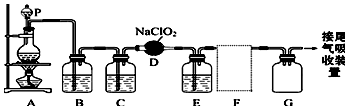

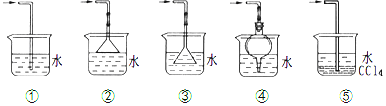
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
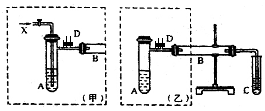 实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:${\;}_{\;}^{18}$O | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | CH4分子的比例模型: | |
| D. | 乙炔分子的电子式: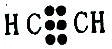 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com