
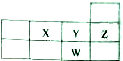
| A. | 原子半径大小:W>Y>X | B. | 核电荷数:W>Z>Y>X | ||
| C. | W的氧化物对应的水化物为强酸 | D. | X是ⅥA族元素,其最高化合价为+6价 |
分析 由五种元素在周期表中的位置可知,X为O元素,Y为F元素,W为Cl元素,Z为Ne元素.
A.同周期自左而右原子半径进行,电子层越多原子半径越大;
B.同周期自左而右核电荷数增大,电子层越多核电荷数越大;
C.W的氧化物对应的水化物不一定为强酸,如HClO属于弱酸;
D.氧元素没有最高价+6.
解答 解:由五种元素在周期表中的位置可知,X为O元素,Y为F元素,W为Cl元素,Z为Ne元素.
A.同周期自左而右原子半径进行,电子层越多原子半径越大,故原子半径:W>X>Y,故A错误;
B.同周期自左而右核电荷数增大,电子层越多核电荷数越大,故核电荷数:W>Z>Y>X,故B正确;
C.W的氧化物对应的水化物不一定为强酸,如HClO属于弱酸,故C错误;
D.X是氧元素,属于ⅥA族元素,但氧元素没有最高价+6,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,难度不大,注意周期表中元素化合价的特殊性.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金在高温下发生了钝化 | B. | 金越炼硬度越大 | ||
| C. | 金的化学性质稳定,不易变质 | D. | 金的硬度大,高温下难于变形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应;
CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com