
分析 (1)根据Ksp=c(K+)×c{[B(C6H5)4]-},结合c(K+)降至1.0×10-6 mol•L-1进行求算;
(2)实验步骤②是从溶液中获得一定质量的固体,需要经过过滤、洗涤、干燥、称量操作;
(3)根据题意可知,9.9800g样品中含有:n(K+)=1.7900g×4/358 g•mol-1=0.02000mol,n(SO42-)=2.3300g×4/233 g•mol-1=0.04000mol,由电荷守恒知:3n(Cr3+)+n(K+)=2n(SO42-),可得n(Cr3+)=(0.04000mol×2-0.02000mol)×$\frac{1}{3}$=0.02000mol,n(H2O)=(9.9800g-0.02000mol×39 g•mol-1-0.04000mol×96g•mol-1-0.02000mol×52 g•mol-1)÷18g•mol-1=0.2400mol,据此可确定各离子和水的物质的量之比,进而确定化学式.
解答 解:(1)根据 Ksp[B(C6H5)4]=2.5×10-13=c(K+)×c{[B(C6H5)4]-},将c(K+)=1.0×10-6mol•L-1带入可得cc{[B(C6H5)4]-}=2.5×10-7mol/L,
故答案是:2.5×10-7;
(2)从溶液中获得一定质量的固体需要经过过滤、洗涤、干燥、称量操作,故答案为:过滤、洗涤、干燥、称量;
(3)根据题意可知,9.9800g样品中含有:n(K+)=1.7900g×4/358 g•mol-1=0.02000mol,n(SO42-)=2.3300g×4/233 g•mol-1=0.04000mol,由电荷守恒知:3n(Cr3+)+n(K+)=2n(SO42-),可得n(Cr3+)=(0.04000mol×2-0.02000mol)×$\frac{1}{3}$=0.02000mol,n(H2O)=(9.9800g-0.02000mol×39 g•mol-1-0.04000mol×96g•mol-1-0.02000mol×52 g•mol-1)÷18g•mol-1=0.2400mol,所以n(K+):n(Cr3+):n(SO42-):n(H2O)=0.02000mol:0.02000mol:0.04000mol:0.2400mol=1:1:2:12,所以样品的化学式为:KCr(SO4)2•12H2O,
故答案为:KCr(SO4)2•12H2O.
点评 本题考查了溶度积的计算和化学式的推断,中等难度,注意利用电荷守恒来确定铬离子物质的量.


科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2为V形的极性分子 | |
| B. | SO2与O3互为等电子体 | |
| C. | NaCl的晶格能高于KCl | |
| D. | 第一电离能由高到低的顺序为:F>O>N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| B. | 纤维素→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂→甘油和高级脂肪酸→CO2和H2O(释放能量维持生命活动) | |
| D. | 麦芽糖→葡萄糖→CO2和H2O(释放能量维持生命活动) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
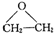 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$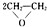 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 一种元素可形成多种离子 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种活动性不同的金属 | |
| B. | 由CH4、O2和KOH构成的燃料电池中,通入CH4的电极为正极 | |
| C. | 原电池工作时,负极发生氧化反应,化合价降低 | |
| D. | 铜锌原电池工作时,当有13 g锌溶解时,电路中有0.4 mol电子通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com