
| A. | Na2O2→O2 | B. | FeCl2→FeCl3 | C. | KClO3→O2 | D. | Al2O3→AlO${\;}_{2}^{-}$ |
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
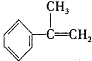 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式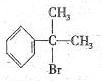 .
.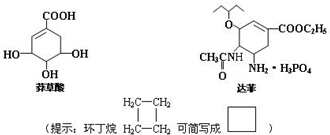
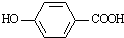 ),其反应类型为:消去反应;
),其反应类型为:消去反应;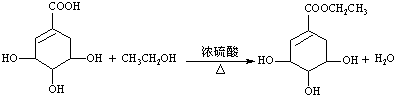 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑥ | C. | ⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
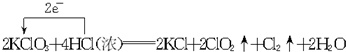 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 元素的单质可由氧化或还原含该元素的化合物来制得 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
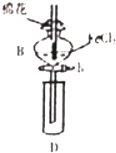 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 华裔科学家高琨因在光纤传输信息领域中取得突破性成就而获得诺贝尔奖,光纤的主要成分是高纯度的二氧化硅 | |
| C. | 玻璃钢是一种合金,广泛用于汽车车身 | |
| D. | 只要符合限量,“亚硝酸盐”、“食用色素”、“苯甲酸钠”可以作为某些食品的添加剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com