
| A. | 加入氯化铵固体,溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 加水不断稀释,溶液碱性一定增强 | |
| C. | 加水稀释,平衡常数Kb增大 | |
| D. | 加入NaOH固体,平衡逆向移动 |
分析 A、加入氯化铵,稀氨水中存在电离平衡逆向移动,氢氧根离子的浓度减小;
B、加水促进电离,但氢氧根离子的浓度减小;
C、由NH3.H2O?NH4++OH-,只要温度不变,则电离平衡常数不变;
D、加入氢氧化钠固体,氢氧根离子的浓度增大,电离平衡逆向移动.
解答 解:A、加入氯化铵固体,铵根离子的浓度增大,则稀氨水中存在电离平衡逆向移动,氢氧根离子的浓度减小,由水的离子积可知,氢离子的浓度增大,则溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$变大,故A错误;
B、加水促进电离,氢氧根离子的物质的量增大,但溶液体积增大的更多,故氢氧根离子的浓度减小,从而碱性减弱,故B错误;
C、由NH3.H2O?NH4++OH-,加水虽促进电离,但没有改变温度,则电离平衡常数不变,故C错误;
D、加入氢氧化钠固体,氢氧根离子的浓度增大,生成物中离子浓度变大,则电离平衡向左移动,故D正确;
故选D.
点评 本题考查弱电解质的电离平衡,明确温度、浓度等影响电离平衡的因素是解答本题的关键,并注意温度不变、电离常数不变来解答.


科目:高中化学 来源: 题型:解答题
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.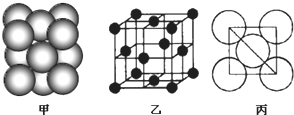
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成它的小分子结构简式为CH2=CHCOOR(R为烃基) | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 没有固定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
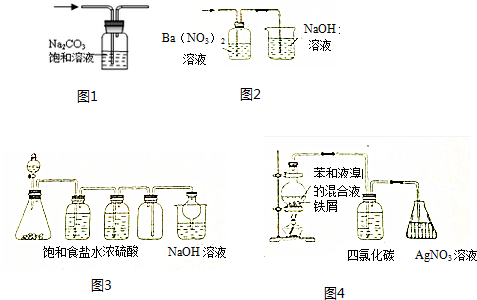
| A. | 用图1装置出去CO2中混有的HCl气体 | |
| B. | 用图2装置除去SO2中混有的SO3气体 | |
| C. | 用图3装置可以制备并收集Cl2 | |
| D. | 用图4装置证明苯与液溴能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
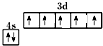
| A. | 水分子的电子式为 | |
| B. | Ca2+基态电子排布式为1s22s22p63s23p6 | |
| C. | 基态氟原子排布图为 | |
| D. | 钾的原子结构示意图为 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com