
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 由沙子制备光伏材料时的反应之一为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑ | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 |
分析 A.HF与二氧化硅反应;
B.光伏材料为Si,利用C还原二氧化硅制备;
C.SiO2能与NaOH反应生成硅酸钠和水;
D.水晶的成分为二氧化硅.
解答 解:A.HF与二氧化硅反应,则氢氟酸不能盛放在玻璃试剂瓶中,可利用塑料瓶,故A正确;
B.光伏材料为Si,利用C还原二氧化硅制备,发生SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故B正确;
C.SiO2能与NaOH反应生成硅酸钠和水,则灼烧NaOH固体时不能使用瓷坩埚,使用铁坩埚,故C正确;
D.水晶的成分为二氧化硅,而玻璃、陶瓷的主要成分均是硅酸盐,故D错误;
故选D.
点评 本题考查物质的性质,为高频考点,把握物质的性质、性质与用途、试剂的保存等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
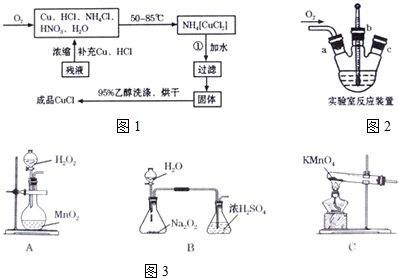
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐中阴离子的结构示意图为  | |
| B. | 氧化亚铁溶于足量稀硝酸的离子方程式:FeO+2H+=Fe2++H2O | |
| C. | NaHS水解的离子方程式:HS-十H20?H3O++S2- | |
| D. | 用惰性电极电解氯化钠溶液,阳极电极反应式:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
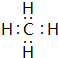 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O═H2SO4+2HI | ||
| C. | H2O2+H2SO4═SO2+O2↑+H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com