
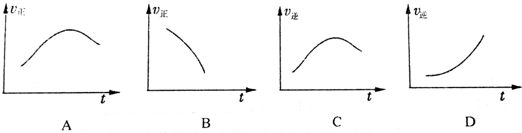

分析 (1)根据盖斯定律求解;
(2)①反应是从正向开始的,不可能逆反应速率增大后又减小;
②容器恒容绝热,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反应放热,若在该容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),则开始反应放热;若在容器中加入II:1molSO3(g)和1mol NO(g),则开始时反应吸热,据此分析平衡常数;
(3)①pKa越小,酸性越强;
②根据盐类水解离子浓度大小比较方法解答;
(4)①从图形中有氧时NO的转化率高于无氧;
②可能的原因是在温度较高时,NH3被氧气催化氧化.
解答 解:(1)因为:①.2SO2(g)+O2(g)?2SO3 (g)△H=-196.6kJ•mol-1
②.SO2(g)+NO2 (g)?SO3(g)+NO(g)△H=-41.6kJ•mol-1
根据盖斯定律,则③2NO(g)+O2 (g)?2NO2 (g),③=①-②×2,△H═-196.6-(-41.6)×2=-113.4kJ•mol-1,故答案为:-113.4;
(2)①反应是从正向开始的,不可能逆反应速率增大后又减小,故C错误,故答案为:C;
②容器恒容绝热,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反应放热,若在该容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),则开始反应放热,温度升高平衡左移,K减小;若在容器中加入II:1molSO3(g)和1mol NO(g),则开始时反应吸热,温度降低平衡右移,K增大,故该反应的平衡常数Ⅰ<Ⅱ,故答案为:<;
(3)①因为HNO2的pKa=3.15,H2CO3的pKa1=6.37,故酸性HNO2的酸性比H2CO3的酸性强,故答案为:强;
②碳酸钠与二氧化氮1:1反应后溶液中溶质有硝酸钠、亚硝酸钠、碳酸钠,亚硝酸根和碳酸根要水解,使溶液呈碱性,故硝酸根离子浓度最大,碳酸根离子水解程度大于亚硝酸根,故离子浓度大小顺序为:c(NO3-)>c(NO2-)>c(CO32-)>c(OH-)>c(HCO3-),
故答案为:c(NO3-)>c(NO2-)>c(CO32-)>c(OH-)>c(HCO3-);
(4)①从图形中有氧时NO的转化率高于无氧,二氧化碳产量高,
故答案为:有氧;
②在有氧的条件下,随着反应温度的进一步升高,NO的转化率明显下降,NO2产率明显提高,可能的原因是在温度较高时,NH3被氧气催化氧化,发生了反应4NH3+5O2═4NO+6H2O,2NO+O2═2NO2,
故答案为:温度较高时,NH3被氧气催化氧化,发生了反应4NH3+5O2═4NO+6H2O,2NO+O2═2NO2或4NH3+7O2═4NO2+6H2O.
点评 本题考查了热化学方程式书写和盖斯定律计算应用,化学反应速率的图象分析,盐类水解的应用等考点,要求学生学会识图,提取信息解决问题的能力,题目难度中等.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
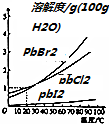
| A. | 三种卤化铅的溶解度均随温度的升高而减小 | |
| B. | 20℃时,PbCl2的Ksp约为1.87×10-4 | |
| C. | 任何温度下,始终存在:Ksp(PbCl2>Ksp(PbBr2>Ksp(PbI2) | |
| D. | 常温下,向浓度均为0.1mol•L-1的Cl-、Br-、I-混合溶液中,逐滴加入的Pb(NO3)2溶液,PbCl2最先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
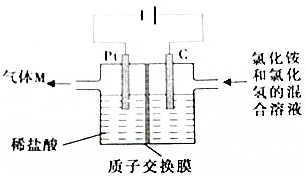 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )| A. | 每生产1molNCl3,理论上有4molH+经质子交换膜有右侧向左侧迁移 | |
| B. | 可用湿润的淀粉纸质检验气体M | |
| C. | 石墨极的电极反应式为NH4++3Cl--6e-=NCl3+4H+ | |
| D. | 电解过程中,质子交换膜右侧溶液的pH会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘酒是指单质碘的乙醇溶液 | |
| B. | 化合反应均为氧化还原反应 | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
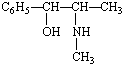 属醇类化合物(填“醇”或“酚”)
属醇类化合物(填“醇”或“酚”)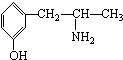 B.
B.
 D.
D.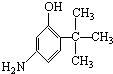 E.
E.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA | |
| D. | 室温下,将9g铝片投入0.5L18.4mol•L-1的H2SO4中,转移的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com