
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为2Fe+3H2O(g)=Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:
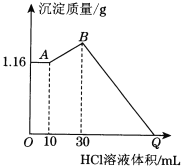
①A点的沉淀物的化学式为________;B点的沉淀物的化学式为________________________;写出A→B段发生反应的离子方程式_____________________________。
②原混合物中MgCl2的质量是________g,AlCl3的质量是________g,NaOH的质量是________g。
③Q点HCl溶液加入量是________mL。
【答案】A Mg(OH)2 Mg(OH)2和Al(OH)3 AlO2-+H++H2O=Al(OH)3↓ 1.90 2.67 5.20 130
【解析】
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,前10毫升盐酸反应时沉淀量不变,说明盐酸和氢氧化钠反应,则白色沉淀为氢氧化镁沉淀,再加入盐酸产生沉淀,是偏铝酸钠和盐酸反应生成氢氧化铝沉淀,再加入盐酸,氢氧化镁和氢氧化铝沉淀全部溶解。据此解答。
(1) A.金属钠非常活泼,容易和水或氧气反应,在实验室中保存在石蜡油或煤油中,故正确;B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,外面有氧化铝薄膜包着,不会滴下,故错误;C.铁单质与水蒸气反应的化学方程式为2Fe+4H2O(g)![]() Fe3O4+4H2,故错误。故选A;
Fe3O4+4H2,故错误。故选A;
(2) ①先加入的盐酸和氢氧化钠反应,说明白色沉淀为 Mg(OH)2,再加入盐酸,又产生了氢氧化铝沉淀,所以B点为 Mg(OH)2和Al(OH)3 ;A到B的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;
②氢氧化镁沉淀的质量为1.16克,即0.02mol氢氧化镁,则对应的氯化镁的物质的量为0.02mol,质量为0.02mol×95g/mol= 1.90g, 根据AlO2-+H++H2O=Al(OH)3↓分析,反应消耗的盐酸的物质的量为1mol/L×(30-10)×10-3L=0.02mol,则氯化铝的物质的量为0.002mol质量为0.02mol×133.5g/mol= 2.67g,氢氧化钠的物质的量为0.02×2+0.02×4+1×0.01=0.13mol,则质量为0.13 mol ×40 g/mol = 5.20g;
③Q点HCl溶液可以看成就是将原来的氢氧化钠反应生成氯化钠,故根据0.13mol氢氧化钠计算,盐酸的物质的量为0.13mol,体积为![]() =130mL。
=130mL。


科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)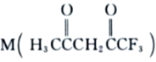 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、CO等大气污染气体的处理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0 kJ·mol1,②N2(g) +O2(g)
CO2(g)+NO(g) ΔH1=234.0 kJ·mol1,②N2(g) +O2(g)![]() 2NO(g)ΔH2=+179.5 kJ·mol1,③2NO(g)+O2(g)
2NO(g)ΔH2=+179.5 kJ·mol1,③2NO(g)+O2(g)![]() 2NO2(g) ΔH3=112.3 kJ·mol1,反应2NO2(g) +4CO(g)
2NO2(g) ΔH3=112.3 kJ·mol1,反应2NO2(g) +4CO(g)![]() N2(g)+4CO2(g)的ΔH=__________ kJ·mol1。
N2(g)+4CO2(g)的ΔH=__________ kJ·mol1。
(2)在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g) +4CO2(g),测得相关数据如下:
N2(g) +4CO2(g),测得相关数据如下:
0 min | 5 min | 10 min | 15 min | 20 min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①在0~10 min,用CO2的浓度变化表示的反应速率为______________。
②为使该反应的反应速率增大,下列措施中可采用的是________(填字母代号)。
a.减小压强 b.适当升高温度 c.增大CO的浓度 d.选择高效催化剂
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
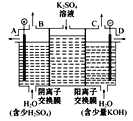
①该电解槽的阳极反应式为_______。此时通过阴离子交换膜的离子数____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口____(/span>填“A”“B”“C”或“D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:
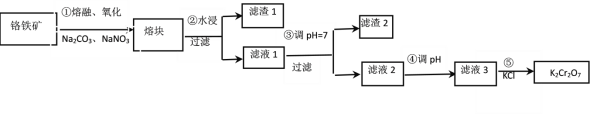
已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+ ![]() Cr2O72-+H2O,下列说法正确的是
Cr2O72-+H2O,下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L CO2共转移7mol电子
C. 步骤④若调节滤液2的pH使之变小,则有利于生成Cr2O72—
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同。试根据甲、乙的密度(ρ)的关系,下列说法中正确的是
A. 若ρ(甲)>ρ(乙),则气体体积:甲<乙
B. 若ρ(甲)>ρ(乙),则分子数:甲>乙
C. 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙
D. 若ρ(甲)<ρ(乙),则气体的压强:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
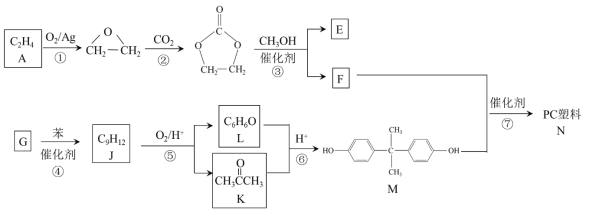
已知:
i.R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
ii.R1CH=CHR2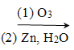 R1CHO + R2CHO
R1CHO + R2CHO
(1)A 中含有的官能团名称是______。
(2)①、②的反应类型分别是______、______。
(3)③的化学方程式是______。
(4)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是______。
(5)⑥中还有可能生成的有机物是______(写出一种结构简式即可)。
(6)⑦的化学方程式是______。
(7)己二醛是合成其他有机物的原料。L经过两步转化,可以制备己二醛。合成路线如下:

中间产物1的结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为有机物,其中A 常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。已知醛基在氧气中易氧化成羧基,请回答下列问题:
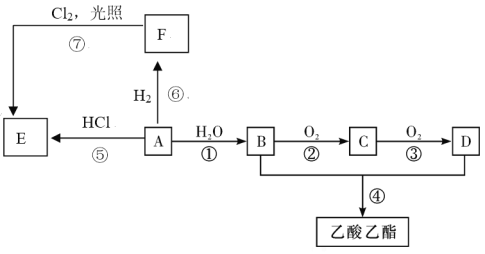
(1)A的分子式是_________,B中官能团的名称_____________。在反应①~④中,属于加成反应的是__________(填序号)。
(2)写出反应②的化学方程式:______________________________________________。
写出反应④的化学方程式:_________________________________________________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的结构简式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com