
【题目】已知:硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和___。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有___气体产生,写出D中发生反应的离子方程式__。若去掉C,是否能得出同样结论并解释其原因___。
(3)为验证A中残留物是否含有FeO,需要选用的试剂有___。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(4)已知分解产物中的某气体能使紫色石蕊试液变蓝,该气体被氧气连续氧化为红棕色气体,第一步催化氧化的化学反应方程式为:__。
(5)上述红棕色气体易溶于水,当该气体与氧气按5:1的体积比混合后装满试管倒置于水中,待液面稳定后试管中的气体体积变为原体积的__。
(6)E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,根据氧化还原反应的基本规律,x、y和z应满足的关系为__。
【答案】SO2 SO2 H2O2+SO2+Ba2+=2H++BaSO4↓ 不能,若有SO3也有白色沉淀产生 BD 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O ![]() 3x+y=z
3x+y=z
【解析】
(1)该反应为氧化还原反应,根据化合价升降守恒规律进行判断;
(2)C中无明显现象,D中有白色沉淀生成说明SO2被H2O2氧化后生成SO3,与氯化钡反应生成硫酸钡沉淀; SO3若存在也会出现同样的现象;
(3)验证A中残留物是否含有FeO,可将残留物溶于硫酸中,加入KMnO4溶液,观察KMnO4溶液是否褪色;
(4)能使紫色石蕊试液变蓝的气体是NH3,NH3催化氧化后能生成NO和水;
(5)红棕色气体为NO2,与水反应生成HNO3和NO;
(6)根据化合价升降守恒判断。
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,铁和氮的化合价升高,只能硫的化合价降低,所以气体产物可能有NH3、SO3、H2O、N2和SO2;
(2)实验中,观察到C中无明显现象,说明没有SO3生成,D中有白色沉淀生成,可确定产物中定有SO2气体产生,则D中发生反应的离子方程式H2O2+SO2+Ba2+=2H++BaSO4↓;若有SO3也有白色沉淀产生;若去掉C,不能得出同样结论;
(3)为验证A中残留物是否含有FeO,可将残留物溶于硫酸中,加入KMnO4溶液,观察KMnO4溶液是否褪色,因此需要选用的试剂有稀硫酸和KMnO4溶液;
(4)已知分解产物中的某气体能使紫色石蕊试液变蓝,该气体被氧气连续氧化为红棕色气体,则该气体为NH3,第一步催化氧化的化学反应方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(5)上述红棕色气体NO2和氧气混合溶于水,反应方程式为4NO2+O2+2H2O=4HNO3,当该气体与氧气按5:1的体积比混合后装满试管倒置于水中,剩余气体为1体积NO2,3NO2+H2O=2HNO3+NO,所以待液面稳定后试管中的气体体积变为原体积的![]() ×
×![]() =
=![]() ;
;
(6)E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀BaSO4物质的量为zmol,根据氧化还原反应的基本规律,化合价升降总数相等,则x、y和z应满足的关系为6x+2y=2z,即3x+y=z。


科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4nH2O)是一种重要的食品和饲料添加剂。在实验室里可以通过下列流程用废铁屑制备。
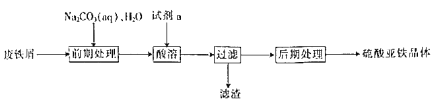
(1)试剂a是___(填写名称),上述流程中涉及的物质主要有①Na2CO3(aq)、②H2O、③试剂a、④废铁屑、⑤FeSO4nH2O,其中属于电解质的是___(填化学式),酸溶时发生的主要反应的化学方程式为___。
(2)上述流程中过滤操作所用的玻璃仪器有玻璃棒__、烧杯。
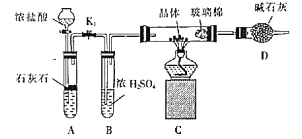
(3)利用如图装置对所得产品(FeSO4nH2O)结晶水的含量进行测定。反应前称量C中的硬质玻璃管(80g)、装入晶体后的硬质玻璃管(93g)。反应后称得C中硬质玻璃管的质量为87.6g。则产品硫酸亚铁晶体(FeSO4nH2O)中n=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)取3.0 g有机物X,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式________。X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(2)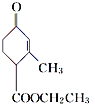 中的含氧官能团名称是________。
中的含氧官能团名称是________。
(3)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为___________。
(4)肉桂酸苯甲酯G是一种香料,主要用于配制人造龙涎香,也可作皂用、化妆用及食用香精的调香原料。如图是用乙烯和甲苯为原料合成肉桂酸苯甲酯的路线图。
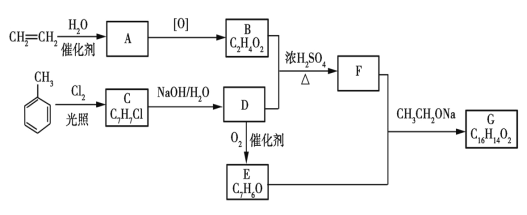
已知:RCHO+CH3COOR'![]() RCH=CHCOOR'。回答下列问题:
RCH=CHCOOR'。回答下列问题:
①A的结构简式是________,F的分子式是___________。
②C生成D的化学方程式是____________。
③D生成E的反应类型是__________。
④含有苯环,与D互为同分异构体的有机物有_____种(不考虑立体异构),其中不能与Na反应的结构简式是___________。
⑤G的结构简式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是元素周期表中第IIIB族钪、钇和镧系元素的总称。第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高新技术产业。回答下列问题:
(1)基态Fe原子的价电子排布式为____;铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同,则晶格能NiO____(填“>”“<”或“=”)FeO。
(2)氨硼烷化合物(![]() )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
)是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
(3)![]() 俗称摩尔盐,相对于
俗称摩尔盐,相对于![]() 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数:![]() 。每个晶胞含有___个钕原子,设阿伏加德罗常数为
。每个晶胞含有___个钕原子,设阿伏加德罗常数为![]() ,则金属钕的密度为___
,则金属钕的密度为___![]() (Nd的相对原子质量为M,列出计算表达式)
(Nd的相对原子质量为M,列出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)aFeb(SO4)c·dH2O又称莫尔盐,是浅绿色晶体,用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
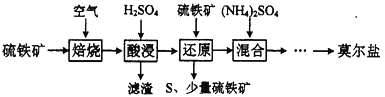
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:__________________________。实验室检验“还原”已完全的方法是:__________________________。
(2)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式(请写出计算过程)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。
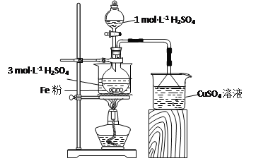
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)实验装置
反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为___。
(2)药品用量
将2gFe粉、10mL3mol·L-1H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是___。
(3)制备FeSO4溶液
保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。为避免在上述过程中析出FeSO4晶体,可采取的措施有__。
(4)制备(NH4)2Fe(SO4)2·6H2O
①向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为___。
②为防止Fe2+被氧化,可采取的主要措施有__(填字母)。
a.(NH4)2SO4固体不配成溶液,直接加入到FeSO4溶液中
b.混合液不蒸发浓缩,直接倒入无水乙醇中析出晶体
c.析出的晶体不用水洗,用90%的乙醇溶液洗涤
d.将实验中所用的乙醇回收,蒸馏后重复使用
(5)产品检验
请补充完整测定产品中SO42-含量的实验方案:准确称取约0.4g样品,溶于70mL水,__,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中须使用的试剂有:2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com