
| ѡ�� | ʵ���������ʵ | ʵ��Ŀ�Ļ���� |
| A | ȡ������Һ���Թ��У�������HNO3�ữ��BaCl2��Һ��������ɫ���� | ˵����Һ��һ������SO42- |
| B | �ֱ�����֧�Թ��м�����������Ũ�ȵĹ���������Һ����������һ֧�Թ��м�������MnO2 | �о������Թ�������ֽ����ʵ�Ӱ�� |
| C | ��Na2CO3��HCl������Һ��μ� | ���Լ�����������Һ |
| D | C2H5Br��AgNO3��Һ��ϼ��� | ����C2H5Br�е���Ԫ�� |
| A��A | B��B | C��C | D��D |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaHCO3��NaOH |
| B��Na2CO3��NaOH |
| C��NaHCO3��Na2CO3 |
| D��Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ơ��ƿ��ƿ�����Ϸ��������ĭ |
| B������������������Һʱ����������� |
| C����������Ĺ��̣����Ĵ�������Ӧ��ͨ�������� |
| D��ʵ���ҳ����ű���ʳ��ˮ�ķ����ռ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����pH��ֽ���ij��ˮ��pHֵΪ6.24 |
| B����������ƽ�Ƶ�����ͭ��ĩ������Ϊ11.5g |
| C����10ml��Ͳȡ8.5ml����Һ |
| D�����ij�������Ȼ��Ƶ���������Ϊ90.5% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1molˮ�к���1mol��ԭ�Ӻ�2mol��ԭ�� |
| B��Ħ���ǻ�ѧ�ϳ��õ�һ�������� |
| C��ij������Һ��H2SO4����������Ϊ0.6 |
| D�������ӵ�����ԼΪ6.02��1023mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ƽ��������Ӧ�����ƶ��� |
| B������A��ת���������� |
| C�����º�ѹʱ�ٳ���A���ʣ��ﵽ�µ�ƽ��ʱA���������������� |
| D��a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
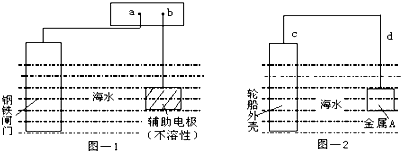
| A��ͼ-1��aΪ��Դ���� |
| B��ͼ-1�������缫�Ϸ���������Ӧ |
| C��ͼ-2����������d��c |
| D��ͼ-2������A��������ʴ�Ľ���ͭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��Na+��+c��H+��=2c��CO32-��+c��HCO3-��+c��OH-�� |
| B��c��Na+��=2[c��CO32-��+c��HCO3-��+c��H2CO3��] |
| C��c��OH-��=c��H+��+c��H2CO3��-c��CO32-�� |
| D��c��Na+����c��CO32-����c��HCO3-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com