
NA为阿伏伽德罗常数的值。下列说法正确的是
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是

A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量小于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a的反应速率更快
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子质量为32g
D.标准状况下,0.5 mol任何物质的体积均约为11.2L
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
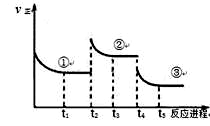
已知:2SO2(g) +O2(g) 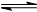 2SO3(g) △H=—196.6kJ·mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是
2SO3(g) △H=—196.6kJ·mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③。
A.t2~t3时间段,平衡向逆反应方向移动
B.平衡状态①和②,平衡常数K值相同
C.平衡状态①和②,SO2转化率相同
D.t4时刻改变的条件是减小压强
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A、同主族元素含氧酸的酸性随核电荷数的增加而减弱
B、核外电子排布相同的微粒化学性质也相同
C、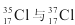 得电子能力相同
得电子能力相同
D、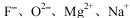 半径逐渐减小
半径逐渐减小
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
将少量Na2O2固体加入到Ca(HCO3)2溶液中,下列有关说法正确的是
A.溶液中只有气体产生
B.溶液中只有沉淀产生
C.溶液中可能有反应Ca2++OH-+HCO-3=CaCO3↓+H2O发生
D.溶液中产生的气体是二氧化碳。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省长沙市高三上学期第三次月考化学试卷(解析版) 题型:选择题
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期第一次月考化学试卷(解析版) 题型:填空题
(每空2分,共10分)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:(提示:NH4HCO3 == NH3↑ + CO2↑ + H2O)
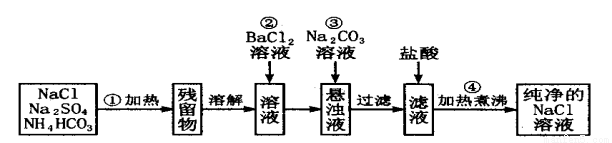
如果此方案正确,那么:
(1)操作①可选择______________仪器。
(2)操作③的目的是_____________,化学方程式是
操作②是否可改为加硝酸钡溶液?为什么?________ 。
(3)操作④的目的是___________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省淄博市高三上学期10月月考化学试卷(解析版) 题型:实验题
(15分)工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
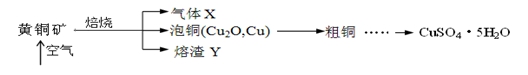
(1)下列装置可用于吸收气体X的是 (填代号)。
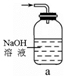
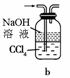
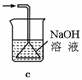
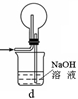
(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为 。
②实验时,依次进行如下操作:组装仪器、 、加装药品、通入气体、 、点燃酒精灯。
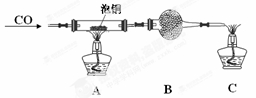
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为 。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定剂 EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2-+ 2H+。则CuSO4·5H2O质量分数为________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com